1.三峡大学 生物与制药学院 中国轻工业酵母功能重点实验室 湖北宜昌 443002
2.安琪酵母股份有限公司 湖北宜昌 443003
摘要:本研究对该嗜酸乳杆菌培养基配方进行了优化,利用单因素实验筛选不同营养类型的酵母浸粉及不同分子量肽段的大豆蛋白胨,最后采用响应面试验设计对培养基组分进行进一步优化得出其最适培养基方案。结果表明,以麦芽糖20g/L,酵母浸粉FM502 20g/L,大豆蛋白胨FP403 20g/L,硫酸镁0.58g/L,硫酸锰0.25g/L,乙酸钠5g/L作为优化后的培养基进行嗜酸乳杆菌的培养,ΔOD600可以达到8.5,活菌数可达到 9.05×108cfu/mL。
Abstract:This research focused on the optimization of culture medium for acidophilus. We selected suitable yeast extract and soybean peptone from different nutritional types of yeast extract and different molecular weight peptides of soybean peptone by single-factor experiment, reached the optimum formulation by Response Surface Experiment and the highest viable count of the cultivation of acidophilus is 9.05×108cfu/mL .The result shows optimum formulation contains Maltose 20g/L, Yeast Extract FM502 20g/L, Soybean Peptone FP403 20g/L, MgSO4 0.58g/L, MnSO4 0.25g/L, Sodium acetate 5g/L.
关键词:嗜酸乳杆菌;培养基优化;酵母浸粉;大豆蛋白胨;响应面设计
嗜酸乳杆菌是人体和动物肠道内的重要有益微生物,与人类和动物肠道健康息息相关[1],也是目前人类膳食补充剂、乳品饮料及饲料添加剂中常见的菌种之一[2, 3]。嗜酸乳杆菌作为工业化的益生菌由来已久,企业的工业生产水平依然参差不齐,生产也面临着一些问题如生产波动大、产品稳定性差等,其中涉及的因素有很多[4],发酵培养基配方往往最受关注。
在乳酸菌发酵培养中有机氮源的影响最为显著[5],本研究在进行嗜酸乳杆菌的培养基优化过程中,着重研究了乳酸菌培养基中常用有机氮源中酵母浸出物、蛋白胨等的选择问题,以期对各生产单位及研究工作者在嗜酸乳杆菌的培养中有所帮助,为嗜酸乳杆菌的发酵原料选择提供一定的数据支撑。
1.1 菌种、试剂与培养基
嗜酸乳杆菌(Lactobacillus acidophilus)由安琪酵母股份有限公司微生物营养事业部保存。
MgSO4、KH2PO4、MnSO4、柠檬酸氢二铵、乙酸钠购自国药
葡萄糖、琼脂粉为国产生化试剂
酵母浸粉FM902、FM803、FM502、FM860、FM808,均由安琪酵母股份有限公司提供
大豆蛋白胨FP401、FP402、FP403、FP404、FP405,均由实验室制备
酵母浸粉及大豆胨型号 | 特点 |
FM902 | 面包酵母浸出物,富含小肽、维生素等 |
FM803 | 面包酵母浸出物,富含游离氨基酸、水解度高 |
FM808 | 面包酵母浸出物,富含多肽 |
FM860 | 面包酵母浸出物,富含海藻糖、水解度低 |
FM502 | 面包酵母浸出物,富含核酸、核苷酸 |
FP401 | 大豆蛋白胨,过150Da纳滤,富含游离氨基酸 |
FP402 | 大豆蛋白胨,富含150~500Da肽段 |
FP403 | 大豆蛋白胨,富含500~1000Da肽段 |
FP404 | 大豆蛋白胨,富含1000~5000Da肽段 |
FP405 | 大豆蛋白胨,富含5000Da以上肽段 |
菌种活化培养基和计数培养基分别为MRS液体培养基和MRS固体培养基,发酵初始培养基为MRS培养基。
MRS培养基:葡萄糖20g/L、MgSO4 0.58g/L、MnSO4 0.25g/L、乙酸钠5g/L、磷酸二氢钾 3g/L、柠檬酸氢二铵2g/L,吐温-80 1mL/L,酵母浸粉5g/L、蛋白胨10g/L,牛肉浸膏10g/L,蒸馏水1L,初始pH 6.5
1.2 仪器设备
FiveEasy Plus FP20 pH计 梅特勒-托利多国际贸易(上海)有限公司
HWS-350生化培养箱 上海比朗仪器有限公司
Sp-750分光光度计 上海光谱仪器有限公司
GI54DWS灭菌锅 致微(厦门)仪器有限公司
SW-CJ-1Cµ型双人单面超净工作台 苏州进化设备有限公司
1.3 方法
1.3.1 菌种活化及扩培
取-80℃保存的嗜酸乳杆菌冻存管1支,在MRS平板上划线,37℃培养24h,挑取单菌落活化至新鲜斜面上,37℃培养过夜,用接种环从活化斜面上刮取一环菌体接种于100mL液体MRS培养基中,37℃静置培养过夜[6]。
1.3.2 发酵培养基试验设计:单因素实验
碳源的筛选:以MRS培养基为基础,对碳源葡萄糖、蔗糖、麦芽糖、乳糖按等量替换的原则替换MRS中的葡萄糖进行实验,筛选出合适的碳源,初步确定合适的浓度
酵母浸粉的筛选:以MRS培养基为基础,用2%酵母浸粉(FM902、FM860、FM803、FM502、FM808)替代MRS培养基中的全部有机氮源的方式进行实验,筛选出合适的酵母浸粉,并初步确定合适的浓度
大豆蛋白胨的筛选:以MRS培养基为基础,用2%大豆蛋白胨(FP401、FP402、FP403、FP404、FP405)替代MRS培养基中的全部有机氮源的方式进行实验,筛选出合适肽段的大豆蛋白胨,并初步确定合适的浓度
1.3.3 发酵培养基的响应面优化
参考前期的实验,对筛选的对嗜酸乳杆菌有明显影响的碳源、氮源,确定的相应的浓度以及混料设计确定了合适的蛋白胨组合,对这3个具有明显作用的物质进行响应面优化设计,以期达到进一步优化的效果[7]。
1.4 相关指标的测定
1.4.1 pH值的测定
pH值测定用梅特勒pH进行测定
1.4.2 OD600值的测定
微生物菌悬液在600nm条件下的吸光值与生物量之间呈现一定的线性关系,OD600值的变化可以反映出微生物的生长过程及状态,当发酵液的OD600值超过0.8后更具情况用无菌水稀释后进行OD600的测定[8]。
1.4.3 活菌数的测定
活菌总数参照GB4789.35-2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》,采用倾注法,37℃静置培养24h,每个稀释度涂3个平板,活菌总数以每个稀释度的平均数进行计算
2 结果与分析
2.1碳源的筛选及浓度确定
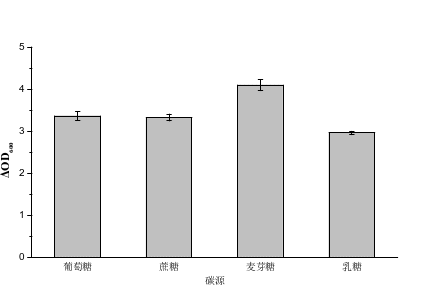
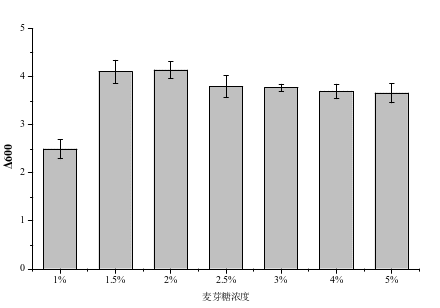
图1 不同碳源对嗜酸乳杆菌的影响 图2 碳源浓度对嗜酸乳杆菌的影响
图1、图2结果显示麦芽糖作为碳源,以1.5~2%的乳糖为碳源,培养嗜酸乳杆菌的ΔOD600可以达到4以上,葡萄糖、蔗糖、乳糖作为碳源,嗜酸乳杆菌的ΔOD600相对较低。该嗜酸乳杆菌可能对麦芽糖存在一定的偏好性,因此选麦芽糖为最适碳源进行浓度优化实验,当碳源浓度为1%时嗜酸乳杆菌的ΔOD600值最低为2.49,随着麦芽糖浓度增加,生物量逐步增长当麦芽糖浓度为2%时,ΔOD600达到最高为4.15,继续增加麦芽糖浓度对生物量影响不显著。
2.2不同营养类型酵母浸粉筛选及浓度确定
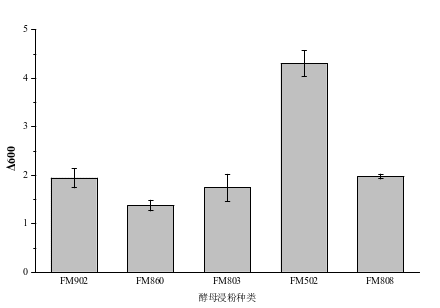
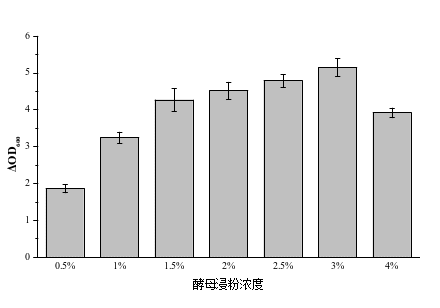
图3 不同氮源对嗜酸乳杆菌的影响 图4 氮源浓度对嗜酸乳杆菌的影响
由图3可知,不同营养类型的酵母浸出物作为单一有机氮源培养嗜酸乳杆菌差异较大,FM502作为氮源培养嗜酸乳杆菌的ΔOD600最大为4.3,使用其他类型酵母浸粉培养嗜酸乳杆菌ΔOD600相对较低。
由图4可知,FM502作为氮源,添加量为0.5%时嗜酸乳杆菌的ΔOD600值最低为1.86,随着添加量的增加,嗜酸乳杆菌的ΔOD600值逐渐增加,当添加量为3%时嗜酸乳杆菌的ΔOD600值最高为5.04,添加量为4%时ΔOD600值降低为3.92。
2.3不同分子量大豆蛋白胨的筛选及浓度确定
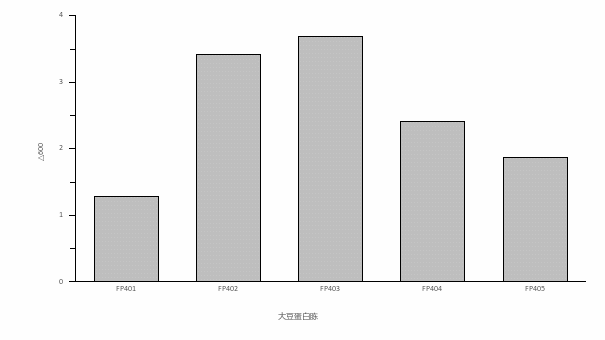
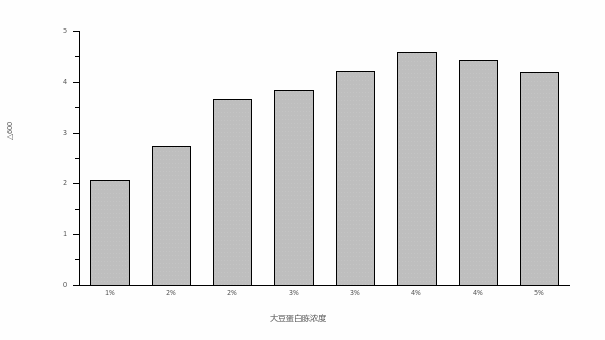
图5 不同大豆胨对嗜酸乳杆菌的影响 图6 大豆胨浓度对嗜酸乳杆菌的影响
由图5可知,不同分子量大小的大豆蛋白胨作为单一有机氮源培养嗜酸乳杆菌差异明显,FP403作为氮源培养嗜酸乳杆菌的ΔOD600最大为3.7,其次是FP402,使用其他分子量大豆蛋白胨培养嗜酸乳杆菌ΔOD600较低。
由图6可知,FP403作为氮源,添加量为1%时嗜酸乳杆菌的ΔOD
600值最低为2.06,随着添加量的增加,嗜酸乳杆菌的ΔOD600值逐渐增加,当添加量为3.5%时嗜酸乳杆菌的ΔOD600值最高为4.58,添加量进一步提高时,ΔOD600值呈下降趋势。
2.6响应面设计与实验分析
表2 响应面优化结果
实验号 | 麦芽糖 | FM502 | FP403 | ΔOD600 |
1 | -1 | -1 | 0 | 4.62 |
2 | 1 | -1 | 0 | 4.15 |
3 | -1 | 1 | 0 | 6.07 |
4 | 1 | 1 | 0 | 4.54 |
5 | -1 | 0 | -1 | 4.65 |
6 | 1 | 0 | -1 | 4.60 |
7 | -1 | 0 | 1 | 5.64 |
8 | 1 | 0 | 1 | 5.43 |
9 | 0 | -1 | -1 | 4.08 |
10 | 0 | 1 | -1 | 5.11 |
11 | 0 | -1 | 1 | 4.38 |
12 | 0 | 1 | 1 | 6.07 |
13 | 0 | 0 | 0 | 5.30 |
14 | 0 | 0 | 0 | 5.55 |
15 | 0 | 0 | 0 | 5.26 |
利于Minitab进行响应面设计进行实验,得到各因素对嗜酸乳杆菌结果的曲面图和等高线图如图8。结果表明酵母浸粉(p=0.005<0.05)对嗜酸乳杆菌生长影响显著,随着酵母浸粉浓度增加,ΔOD600值逐渐增加;大豆蛋白胨(p=0.023<0.05)对嗜酸乳杆菌也有显著影响,随着蛋白胨浓度逐渐增大,ΔOD600值也逐渐增加。而麦芽糖(p=0.063>0.05)对嗜酸乳杆菌的影响不显著,且展现随着浓度逐渐增加,ΔOD600值逐渐降低,此可能与碳氮比有一定关系。
等高线的形状可以判断各因素间交互效应。交互作用不显著时等高线呈圆形,交互作用显著则呈椭圆形,麦芽糖和酵母浸粉、酵母浸粉和大豆蛋白胨有交互明显作用。利用Minitab对实验结果进行分析和预测结果表明麦芽糖为20g/L,酵母浸粉FM502为20g/L,大豆蛋白胨FP403为20g/L为潜在最优组合。
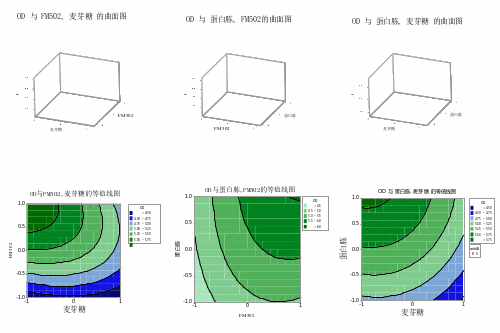
图8 响应面和等高线图
2.7优化后的培养的发酵罐验证实验
以优化后的配方:麦芽糖20g/L,酵母浸粉FM502 20g/L,大豆蛋白胨FP403 20g/L,磷酸二氢钾2g/L,柠檬酸氢二铵2g/L,乙酸钠5g/L,硫酸镁0.58g/L,硫酸锰0.25g/L。装液量2.5L/3L(V/V),接种量2%,控制温度37℃不通氧,搅拌转速150rpm。进行发酵罐实验。
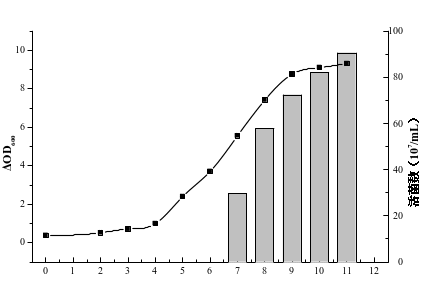
图9 不同时间嗜酸乳杆菌生物量和活菌数
图9结果显示:0~3h嗜酸乳杆菌处于延滞期,3~10h菌液为对数期,10h到达稳定期,此时嗜酸乳杆菌菌液ΔOD600到8.51。随着时间的增加,嗜酸乳杆菌的活菌数也迅速增加,7h嗜酸乳杆菌的菌数2.97×108cfu/mL,11h嗜酸乳杆菌到达稳定期,此时菌数最大,达9.05×108cfu/mL。
3 讨论
研究结果显示碳源和氮源对该株嗜酸乳杆菌有较显著的影响,其中碳源的影响可能与该菌种分离前所处的环境有一定关系,存在对某些糖类物质的偏好性[9],很多资料也显示不同乳酸菌对于可利用碳源谱存在一定的差距[10]。
从我们的实验结果可以看出氮源对嗜酸乳杆菌影响最为显著,其中以富含核苷酸物质的酵母浸粉FM502表现最为突出,在进化过程大多数乳酸菌缺失了很多的代谢途径如某些氨基酸的合成途径,核苷酸的从头合成途径等,培养时对营养要求较苛刻[11]。很多资料显示嗜酸乳杆菌对于核酸及其类似物有着极高的敏感性和较大量的外源需求,因此富含核苷酸的产品将会有助于乳酸菌合成通路的效率提升,从而促进乳酸菌增殖效率和效果的提升。
蛋白胨的筛选中,富含不同分子量的大豆蛋白胨表现出了较大的差异,其中以富含500-1000Da肽段的FP403效果最为显著,而富含小分子游离氨基酸的FP401培养效果最差,表明嗜酸乳杆菌在氮源吸收时,对小肽具有更大的偏好性。很多其他研究中也报道了这一现象,乳酸菌在全价氨基酸和蛋白水解物进行培养时,其最佳氮源是寡肽而非氨基酸[12]。不同分子量的大豆蛋白胨除了肽分子量大小存在差异外,在其他方面也存在一定的差异,比如FP401中钾、钠等构成灰分的离子含量高;FP403中钙、镁含量较为丰富,也是引起培养差异的原因之一。
同时,越来越多的发酵企业要求非动物源的氮源,本研究中所涉及酵母浸出物和大豆蛋白胨均为非动物源、非转基因原料,在应用和认证上具备非常大的优势,是未来益生菌行业的有机氮源首选[13]。
4结论
本实验研究嗜酸乳杆菌的培养基优化,得到以下结论:
1、嗜酸乳杆菌优化后的培养基配方为:麦芽糖20 g/L,酵母浸粉FM502 20 g/L,大豆蛋白胨FP403 20g/L、缓冲盐柠檬酸氢二铵2g/L,磷酸氢二钾2g/L,硫酸镁0.58 g/L,硫酸锰0.25 g/L,以该配方进行嗜酸乳杆菌发酵罐实验,活菌数可达9.05×108cfu/mL。
2、高核酸的酵母浸出物FM502是嗜酸乳杆菌的最适酵母浸出物。
3、富含800-2000Da分子量肽段的FP403是嗜酸乳杆菌的最适大豆蛋白胨。
参考文献
[1] 郭雪, 肖燕, 张璐. 复方嗜酸乳杆菌联合阿米替林治疗难治性腹泻型肠易激综合征对血清炎性因子影响及临床效果[J]. 临床误诊误治, 2019,32(05):39-43.
[2] 梁东梅, 李玉鹏, 杜艳芬, 等. 三株乳酸杆菌的分离鉴定与益生特性研究[J]. 中国饲料, 2018(11):24-29.
[3] 王昕悦.优良嗜酸乳杆菌的选育及其菌剂制备技术研究[D]. 南昌大学发酵工程, 2015.
[4] Senz M, van Lengerich B, Bader J, et al. Control of cell morphology of probiotic Lactobacillus acidophilus for enhanced cell stability during industrial processing[J]. Int J Food Microbiol, 2015,192:34-42.
[5] 李琴, 燕永亮, 苏磊, 等. 一般氮代谢调控蛋白NtrC的研究进展[J]. 中国农业科技导报, 2013,15(03):113-122.
[6] 宋艳, 李岳飞, 王智鼎, 等. 嗜酸乳杆菌高密度培养工艺条件的优化及其评价[J]. 吉林大学学报(医学版), 2013,39(05):1036-1040.
[7] 袁林, 张明华, 涂熠坤, 等. 响应面法优化包被发酵嗜酸乳杆菌的高密度培养[J]. 中国酿造, 2019,38(02):104-110.
[8] 谭欢.乳酸菌高效增殖条件的探索及直投式发酵剂的研制[D]. 湖南农业大学, 2007.
[9] Hsieh S C, Liu J M, Pua X H, et al. Optimization of Lactobacillus acidophilus cultivation using taro waste and evaluation of its biological activity[J]. Appl Microbiol Biotechnol, 2016,100(6):2629-2639.
[10] Schar-Zammaretti P, Dillmann M L, D'Amico N, et al. Influence of fermentation medium composition on physicochemical surface properties of Lactobacillus acidophilus[J]. Appl Environ Microbiol, 2005,71(12):8165-8173.
[11] Eyssen H, Swaelen E, Kowszyk-Gindifer Z, et al. Nucleotide requirements of Lactobacillus acidophilus variants isolated from the crops of chicks[J]. Antonie Van Leeuwenhoek, 1965,31(3):241-248.
[12] 白凤翎, 张柏林, 赵宏飞. 大豆蛋白水解物促酸奶乳酸菌增殖及生长动力学研究[C].中国食品科学技术学会第八届年会暨第六届东西方食品业高层论坛论文摘要集. 2011.
[13] 赵燕霞.嗜酸乳杆菌IMAU30067高密度培养工艺研究[D]. 内蒙古农业大学, 2018.