柳州市人民医院 广西 530000
背景:有证据表明危重病人的疼痛可能被低估。系统的疼痛评估方法对于改善患者的预后至关重要。
目的:探讨系统疼痛评估方法对危重病人疼痛发生率、强度及相关临床结果的影响。
方法:随机对照研究,将连续的危重病人分为标准治疗组和系统疼痛评估组。所有参与者每天完成两次行为疼痛量表(BPS)和临界疼痛观察工具(C-POT)。干预组告知临床医生疼痛评分。干预的纵向效应采用线性混合模型(LMM)。
结果:共纳入117例患者(对照组:n1=61;干预组:n2=56)。干预组疼痛发生率(C-POT>2)明显低于对照组(p<0.001)。干预对疼痛强度有统计学意义(BPS,p=0.01)。干预组吗啡平均总等效剂量高于对照组(p=0.045),丙泊酚平均总剂量高于对照组(p=0.027)。ICU死亡率(23.4%对19.3%,p=0.38,比值比0.82[0.337-1.997])和ICU住院时间(13.5,SD 11.1对13.9,SD 9.5天,p=0.47)无统计学差异。
结论:系统的疼痛评估可能与疼痛强度和发生率的降低有关,并影响危重病人疼痛和镇静的药理学处理。
一、引言
重症患者的疼痛与不良的生理和心理结果相关,并影响重症监护病房(ICU)出院后患者的生活质量。尽管重症患者和镇痛药的疼痛评估方法取得了显着进步,但重症患者的疼痛仍未解决。[1]
充分缓解疼痛的第一步是对疼痛进行系统的评估和记录。无法评估疼痛与ICU死亡有关,而危重病人的常规疼痛评估与改善的预后相关,包括减少机械通气时间,延长ICU停留时间,死亡率和并发症。[2, 3]根据重症医学会的最新建议,应常规监测疼痛,当患者无法自我报告时,强烈建议使用有效的行为疼痛量表。但是,数据显示,全世界的ICU中尚未完全实施循证实践指南,使患者容易遭受疼痛和相关并发症。[4]一项最近的研究探讨了新西兰和澳大利亚重症监护病房的镇痛和镇静评估和管理实践的普遍性,该研究报告称,只有三分之二的镇静患者被正式评估了镇静水平,并且只有一半的患者进行了疼痛评估。[5, 6]此外,由于随机对照试验(RCT),缺乏关于系统性疼痛评估有效性的证据。
1.1 目的
通过连续ICU患者的RCT设计,我们旨在研究系统评估疼痛对疼痛发作(主要结果)发生率的影响。次要结果包括疼痛强度,使用镇痛药和镇静剂,ICU住院时间,机械通气时间,生存率以及不良事件的发生。
二、材料和方法
2.1 设计
这是一个随机,对照,重复措施的试验,分为两个平行组(干预组和标准护理组,分配比例为1:1)。
2.2 设置
这项研究是在XX医院的17张病床的学术混合医疗/外科/创伤重症监护病房中进行的,雇用了70多名注册护士。在研究之前,该单位未使用任何疼痛评估/管理政策。
2.3 患者情况
在12个月内(2014年7月至2015年7月),每天对连续的成年患者进行筛查。同意的参与者基于以下因素被随机分配到干预组或对照组
计算机生成的随机数表。 12排除标准如下:(a)预期ICU停留时间<24小时的患者,(b)接受神经肌肉阻滞剂的患者,(c)患有以下疾病的患者:格林-巴利(Guillain-Barre),周围神经病变,可改变疼痛刺激的感觉传递,以及任何使疼痛行为评估变得复杂的疾病或病状,例如前脑营养状态或营养状态,(d)列治文躁动-镇静量表(RASS)中的躁动> 3,(e)18岁以下。
2.4 样本量
样本量的计算是通过使用G power 3.1版的功率分析进行的。使用了以前研究的证据,不同研究的效果大小似乎有很大差异,期望的样本大小在5到88之间。考虑到平均效应大小,期望样本大小估计为每组60名参与者,这足以确定效应大小(d)为0.5,双侧试验,α为0.05,统计功率为80%。120个样本(60个/组)仅为主要对象。
2.5 随机化、盲目性和隐蔽性
随机分组基于计算机生成的随机数表,并根据最初的危重症护理疼痛观察工具(C-POT)评分(C-POT<2和C-POT>2)创建两个分配块。受试者和结果评估者对组分配是盲目的,但由于研究的设计,临床医生不盲目;然而,他们对研究假设是盲目的。
2.6 干预研究
两组患者均接受标准护理,每天两次(0800-1000和1400-1600之间)额外的疼痛系统评估,连续10天。此外,在干预组,疼痛评估结果以标准化的方式传达给临床医生。临床医生(包括护士或医生或两者)被告知,患者C-POT为2-3出现“一些疼痛迹象”,C-POT为4-5出现“一些疼痛迹象”,C-POT为6-8出现“许多疼痛迹象”,行为疼痛量表为4-6出现“中度疼痛”,BPS为7-9出现“严重疼痛”,对于10-12岁的BPS来说“非常严重的疼痛”。任何关于镇痛的决定都是由临床医生独立做出的,无需研究人员的投入,并记录镇痛或其他措施的变化。所有的评估都是由独立的评估人员进行的,这些评估人员接受了研究人员使用疼痛评估工具的培训,并且对组的分配是盲目的。
2.7 结果
2.7.1主要结果
主要结果是疼痛发作的发生率定义为C-POT评分>2或0-10数字评分量表(NRS)>3。
2.7.2 次要结果
次要结果是疼痛强度(C-POT、BPS或NRS评分)、阿片类药物(吗啡当量(mEq))和非阿片类药物(mg/kg)镇痛、镇静剂(mg)每日剂量、ICU住院时间、机械通气持续时间、存活率和并发症的发生。
2.8 数据标识
对于因任何原因无法交流的参与者,分别在休息时和转动患者时通过BPS(范围:3-12)和C-POT(范围:0-8)评估疼痛。BPS和C-POT被认为是医学外科和创伤icu中评估成人疼痛最有效和最可靠的工具;然而,与BPS相反,C-POT在检测疼痛发作方面有一个临界分数(>2)。因此,C-POT被用来作为一个二分量表(有无疼痛)评估主要结果,以及作为一个连续量表评估次要结果“疼痛强度”,除了BPS。对于能够报告疼痛程度的参与者,我们使用0-10 NRS(0表示没有疼痛,“10”表示可能的最严重疼痛)。BPS和C-POT都显示出与自我报告的疼痛评分高度相关。在本研究的试验阶段,在ICU的10名患者中测试了研究助理之间的水间可靠性。总的来说,我们做了50个疼痛评估来检查同意程度。使用C-POT和BPS进行评估。评估显示C-POT和BPS评分的Spearman相关系数分别为0.96(P<0.001)和0.9(P<0.001)。在数据收集期间定期重复可靠性评估。使用RASS评估镇静/激动程度。上述所有工具(BPS、NRS、C-POT和RASS)均已翻译并验证为希腊语。急性生理学和慢性健康评估II(APACHE II)评分记录在ICU入院后的前24小时内,作为入院时疾病严重程度的衡量标准。
阿片类药物以吗啡当量(mEq)表示,mEq值来自芬太尼、雷米芬太尔和吗啡的组合。芬太尼、瑞芬太尼和吗啡(mg/Kg体重/hr)的给药与吗啡等效物结合使用以下公式(芬太尼+瑞芬太尼)x100+吗啡。非阿片类镇痛药的总剂量按体重的mg/kg计算。镇静药物(苯二氮卓类、异丙酚)的总剂量也以毫克/千克体重表示。
2.9 统计方法
使用t检验(连续变量)和Fisher精确检验(分类变量)比较对照组和干预组的基线特征。用Spearman相关系数探讨cpota与BPS量表的相关性。用logistic回归模型和基于广义估计方程的二元logistic连接函数分析疼痛的纵向发生率。在独立模型准则下,用拟似然方法比较了协方差结构的模型拟合。通过线性混合模型评估干预对纵向疼痛水平的影响,以解释受试者内部相关性、缺失数据和重复测量的协变量。协方差结构和模型拟合使用Akaike信息准则进行评估,其中“Akaike信息准则越低,拟合越好”。所有模型均调整RASS评分作为镇静指标,APACHEⅡ和序贯器官衰竭评估(SOFA)作为疾病严重程度的指标。[7]采用KaplaneMeier曲线和log-rank检验进行时间-事件分析(从ICU入院到死亡)。
三、实验结果
3.1 参与者和基线特征
在研究期间,对286名患者进行资格评估,其中117名患者随机分为对照组(n 1=61)和干预组(n 2=56)。尽管干预组的平均年龄较低(表1),但两组在基线检查时的人口统计学和临床特征以及疼痛评分没有统计学上的显著差异。总体而言,两组均完成了3124个C POT C-POT、1562个BPS和152个NRS疼痛评估。
表1基线时的人口统计学和临床特征(N=117)。
人口统计学和临床特征 | 对照N=61 | 干预N=56 | P* |
人口统计学的 | |||
男性 | 36 (59) | 33 (59) | 0.517 |
年龄 | 64.9 ± 14.5 | 59.5 ± 18.2 | 0.076 |
重量(kg) | 76.1 ± 17.8 | 80.6 ± 16.1 | 0.137 |
诊断 | |||
医学 | 38 (62.3) | 28 (51.90) | 0.456 |
创伤 | 8 (13.1) | 11 (20.4) | |
外科 | 15 (24.6) | 15 (27.8) | |
病史 | |||
糖尿病 | 8 (16.3) | 15 (28.3) | 0.064 |
心脏 | 29 (49.2) | 35 (63.6) | 0.085 |
呼吸系统 | 12 (20.0) | 11 (19.3) | 0.555 |
酒 | 1 (1.7) | 1 (1.9) | 0.73 |
阿片类药物的使用 | 0 (0.0) | 1 (1.8) | 0.482 |
神经病理性疼痛 | 0 (0.0) | 1 (1.9) | 0.478 |
强调 | 0 (0.0) | 1 (1.9) | 0.482 |
抑郁 | 3 (5.3) | 0 (0.0) | 0.132 |
疾病严重程度 | |||
阿帕奇II | 20.6 ± 6.1 | 21.4 ± 6.8 | 0.533 |
萨普斯一号 | 53.9 ± 11.9 | 52.7 ± 15 | 0.532 |
SOFA | 7.2 ± 2.8 | 7.5 ± 3 | 0.599 |
MODS | 5.9 ± 2.8 | 6.2 ± 2.8 | 0.638 |
GCS | 6.5 ± 4.4 | 5.5 ± 4.2 | 0.233 |
RASS | 3.6 ± 2.1 | 4.2 ± 1.8 | 0.105 |
乳酸 | 1.59 ± 1.9 | 1.27 ± 0.6 | 0.236 |
生命体征与氧合 | |||
*SAP | 134.2 ± 21.5 | 131.7 ± 19.4 | 0.508 |
*DAP | 65.3 ± 13.7 | 64.1 ± 11.4 | 0.612 |
*MAP | 86.8 ± 15 | 86.3 ± 13.2 | 0.865 |
*TEMP | 36.9 ± 0.8 | 36.7 ± 1 | 0.254 |
*HR | 90.9 ± 20.2 | 86.6 ± 17.3 | 0.233 |
FiO2 | 47.1 ± 17.1 | 45.5 ± 12.4 | 0.568 |
SAPS | 54 ± 11.9 | 52.4 ± 15.1 | 0.532 |
SpO2 | 97.3 ± 3.3 | 97 ± 12.4 | 0.862 |
说话能力 | 3 (4.9) | 3 (5.3) | 0.544 |
气管造口术 | 57 (95.0) | 55 (98.2) | 0.336 |
机械通风 | 56 (93.3) | 55 (98.2) | 0.204 |
*分类变量采用Fisher精确检验,连续变量采用独立样本t检验。
*APACHE II,急性生理学和慢性健康评估一级;SAPS一级,简化
3.2主要结果:疼痛发作的发生率
随着时间的推移,干预组翻身期间疼痛发作的发生率(C-POT>2)明显低于对照组(p<0.001;表2)。休息时疼痛发作(C-POT>2)的发生率,以及NRS患者自报的疼痛发生率,在两组中都非常低(<2%),因此,无法拟合可靠的模型。
表2疼痛事件干预效果的广义估计方程模型(C-POT>2)。
广义估计方程模型 | 沃尔德·卡方 | df | Sig. |
拦截 | 20.298 | 1 | <0.001 |
干预组 | 6.955 | 1 | 0.008 |
时间 | 2554.609 | 19 | <0.001 |
干预组*时间 | 3185.275 | 18 | <0.001 |
RASS | 24.823 | 1 | <0.001 |
APACHE II | 0.109 | 1 | 0.742 |
SOFA | 0.53 | 1 | 0.467 |
QIC:896;协方差结构:独立。
因变量:转弯时疼痛事件(C-POT>2)。
*RASS,Richmond激动镇静量表;APACHEⅡ,急性生理学和慢性健康评估;SOFA,序贯性器官衰竭评估;QIC,独立模型标准下的准可能性。
3.3 次要结果
3.3.1 疼痛评分
干预似乎对BPS有统计学显著影响(p=0.009),但对休息时(p=0.176)或转弯时(p=0.143;表3)的C-POT评分没有影响。在研究的第一天,BPS和C-POT评分之间的总体关联度为中到高(转前:r=0.455,p<0.001;转后:r=0.571,p<0.001)
表3干预对休息和转身时疼痛水平(BPS)和疼痛指征(C-POT)影响的线性混合模型
依赖变量:BPS疼痛程度 | ||||
来源 | 分子df | 分母df | F | Sig |
拦截 | 1 | 320.443 | 1219.932 | <0.001 |
干预组 | 19 | 260.003 | 1.794 | 0.024 |
时间 | 1 | 224.563 | 4.108 | 0.044 |
干预组* | 19 | 263.045 | 1.996 | 0.009 |
时间 | ||||
RASS | 1 | 557.357 | 54.147 | <0.001 |
APACHE II | 1 | 316.667 | 0.146 | 0.703 |
SOFA | 1 | 304.993 | 0.993 | 0.32 |
依亲变量:C-POT休息时疼痛的指征 | ||||
来源 | 分子df | 分母df | F | Sig |
拦截 | 1 | 292.97 | 55.262 | <0.001 |
干预组 | 19 | 218.192 | 1.565 | 0.067 |
时间 | 1 | 228.249 | 2.183 | 0.141 |
干预组* | 19 | 218.193 | 1.315 | 0.176 |
时间 | ||||
RASS | 1 | 524.175 | 111.694 | <0.001 |
APACHE II | 1 | 282.9 | 1.46 | 0.228 |
SOFA | 1 | 274.707 | 0.982 | 0.323 |
因变量:转向时C-POT疼痛的指示 | ||||
来源 | 分子df | 分母df | F | Sig |
拦截 | 1 | 296.668 | 77.53 | <0.001 |
干预组 | 19 | 195.235 | 1.146 | 0.308 |
时间 | 1 | 220.415 | 3.37 | 0.068 |
干预组* | 19 | 195.108 | 1.374 | 0.143 |
时间 | ||||
RASS | 1 | 530.281 | 68.134 | <0.001 |
APACHE II | 1 | 288.56 | 0.012 | 0.913 |
SOFA | 1 | 276.225 | 1.223 | 0.27 |
AIC=2721;协方差结构:异质一阶自回归。
AIC=2794;协方差结构:异质一阶自回归。
AIC=3589.193;协方差结构:Toeplitz。
*RASS,Richmond激动镇静量表;APACHEⅡ,急性生理学和慢性健康评估一级;SOFA,序贯器官衰竭评估;C-POT,重症监护疼痛观察工具;BPS,行为疼痛量表;AIC,Akaike信息标准。
3.3.2 镇痛镇静
芬太尼、瑞芬太尼和吗啡是用于镇痛的药物。总的来说,干预组(芬太尼=58.9%,瑞芬太尼=33.9%,吗啡=39.3%)的镇痛率高于对照组(芬太尼=54.1%,瑞芬太尼=16.4%,吗啡=29.5%)。然而,这一差异仅在瑞芬太尼组有统计学意义(p=0.024)。
丙泊酚和咪唑安定用于镇静。尽管干预组(异丙酚=85.7%,咪达唑仑=33.9%)接受这些药物治疗的患者比例高于对照组(异丙酚=68.9%,咪达唑仑=19.7%),但这一差异无统计学意义(异丙酚:p=0.127,咪达唑仑:p=0.062)。
在阿片类药物方面,干预组的平均吗啡等镇痛总剂量(mg/kg/研究周期)[20.72,标准差(SD):24.7]高于对照组(13.04,SD:32;p=0.045)。异丙酚平均总剂量干预组(203.2,SD:164.7)也高于对照组(129.9,SD:128.5,p=0.027),咪达唑仑平均总剂量干预组(p=0.252,表4补充文件)。
3.3.3 临床结果
两组机械通气时间(p=0.41)、ICU住院时间(p=0.47)、呼吸机停用天数(p=0.86)差异无统计学意义。干预组的死亡率为19.3%(N=11),对照组为23.4%(N=14)(p=0.38,比值比:0.82[0.337-1997])。对照组和干预组在生存率(对数秩检验p=0.107;图1)和并发症及不良事件方面无统计学差异。发生医院获得性压力损伤(干预n=11(19.6%)vs对照n=15(24.6%),p=0.34)和医院感染(干预n=10(17.9%)vs对照n=12(19.7%),p=0.49)的患者人数干预组低于对照组。
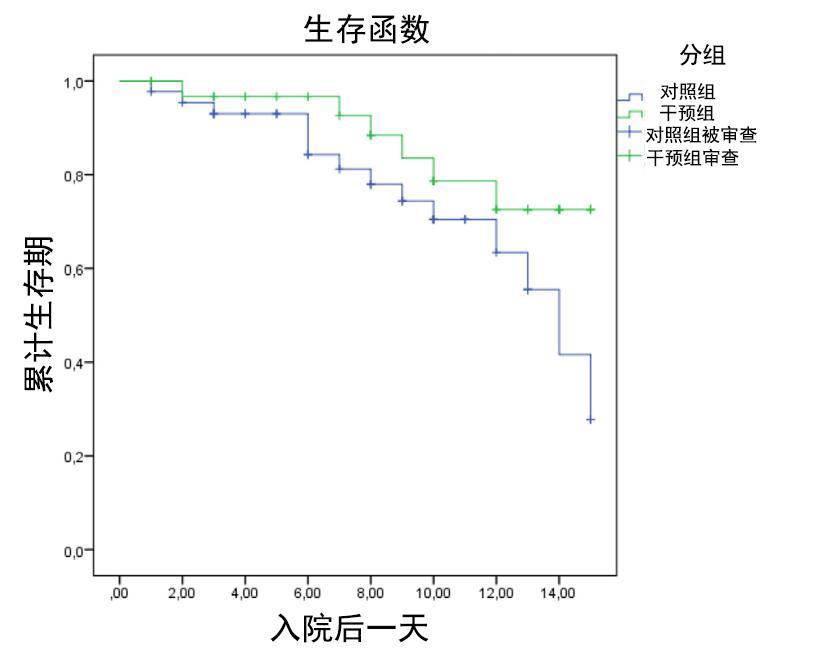
图1 ICU住院15天内死亡事件的生存曲线。死亡事件的kaplanemir生存曲线。在ICU的头15天(ICU住院时间)内监测生存率。审查表明停留时间少于15天且未发生任何事件。对照组显示“较低生存率”,但无统计学意义(对数秩检验,χ2(1)=2.625,p=0.107)。重症监护病房。
四、讨论
人们普遍认识到,对危重病人疼痛的系统评估仍然很少,而且不一致。据我们所知,这是第一次RCT证明,使用结构化系统疼痛评估作为一种独立的护理干预,可以影响危重病人疼痛发作的发生率和强度以及止痛药的使用。以前的结果大多是基于实验前的回顾性或术后设计,具有较高的偏倚风险。
4.1 对疼痛发作和疼痛程度的影响
我们对标准化疼痛评估导致疼痛发生率和疼痛强度降低的观察结果与先前在内科ICU患者中进行的非随机实施前/实施后研究的结果一致,并且与另外两项准实验研究中观察到的非统计显著趋势一致。许多研究已经评估了全面的疼痛管理计划,其中包括系统的疼痛评估,并报告了疼痛发作的减少。[8]与我们的样本相反,这些研究涉及那些有能力自我报告疼痛的患者。尽管患者的自我报告被认为是评估疼痛的“金标准”,但在本研究中,很少有患者能够报告他们的疼痛,因为他们的意识水平低、机械通气或深度镇静。我们的结果与疼痛管理方案的实验研究结果不可直接比较,因为我们没有实施此类方案,也没有对疼痛管理提出建议。
BPS评分与C-POT评分之间存在差异,后者反映了干预组疼痛评分随时间的推移在统计学上显著下降,而C-POT评分则显示出无统计学意义的下降。虽然这可能部分归因于我们的功率计算,这是基于没有使用C-POT的研究,但也可能归因于可能存在的两种工具之间的临床相关差异。BPS被更多地用作疼痛强度的测量手段,而且它似乎比C-POT更具特异性,而C-POT主要是用来表示疼痛的存在。
4.2 对药物的影响
系统疼痛评估对两组阿片类药物和镇静剂的使用有不同的影响。在最近的一次系统综述中,10项研究中有8项报告称,系统疼痛评估影响了每日镇痛剂量,大多数研究报告称,疼痛管理更好,镇痛药和/或镇静剂的使用更有效。在本研究中,干预组患者接受的总mEq剂量显著增加,可能反映了临床医生试图根据疼痛评估来滴定镇痛。系统疼痛评估的目的是准确治疗疼痛,避免过度用药或药物不足。例如,在某些实验研究中,在使用C-POT后,在混合ICU中类阿片镇痛剂的使用增加,而在心血管外科ICU中则减少。
研究发现,在干预组同时使用异丙酚和艾达唑仑的患者比例明显较高,且异丙酚总剂量较高。尽管对异丙酚的疼痛调节作用存在争议,但目前的指南推荐异丙酚作为镇静药,而不是止痛药。
[9, 10]观察到的丙泊酚增加也可以部分解释为缺乏针对重症监护室可接受范围的镇静优化政策。理想情况下,根据止痛原则,有效使用阿片类镇痛药将导致镇静剂的使用减少,以及随之而来的风险和副作用。事实上,我们没有观察到这种趋势,这可能表明需要实施镇痛和镇静方案以及人员培训。当给止痛药和镇静剂命名时,方案和培训有助于将个人偏好、主观性和护士专业水平等变量的影响降到最低。人们普遍认为,危重病护理护士在获得适当的教育和支持等工具后,可以做出有助于患者获得镇静和镇痛的积极结果的决定。[11]
4.3 对临床结果的影响
尽管目前的证据水平强调了系统性疼痛评估和改善危重病人短期预后之间的联系,但这项研究并未显示两组在ICU住院时间、呼吸机休息日和机械通气持续时间方面有任何显著差异。这些结果需要在未来进一步研究,因为我们的试验无法检测这些次要结果的差异。这一发现也可以理解,因为我们的干预并不直接与规定的药理学干预有关。众所周知,使用综合镇静/镇痛方案,包括药理学干预或ICU健康专业人员的教育,与改善预后相关,而不是仅选择特定的镇静/镇痛量表。
因此,只要临床医生对疼痛和镇静的管理有足够的了解,系统的疼痛评估可能是合理有效的镇痛和镇静的一种有价值的方法。此外,过度使用镇静剂可能也部分影响了系统疼痛评估与临床结果之间缺乏联系。许多研究表明,成人ICU患者深部和长时间镇静的负性结果和轻度镇静的正性结果。
尽管我们在干预组的并发症和不良事件方面没有发现统计学上的显著差异,但两项非随机的实施前/实施后研究报告了实施系统疼痛评估后医院感染率(14,n=230)和并发症(16,n=30)的降低。本研究对存活率没有显著影响。在已发表的研究中,疼痛评估对生存率的影响并不一致。在一项研究中,增加疼痛监测独立预测重症监护病房死亡率的降低,而在其他两项研究中,死亡率没有显著差异。在目前的研究中,由于相对罕见的事件,检测对生存的影响可能需要更大的规模。
五、结论和建议
本研究首次应用RCT方法来研究系统评估疼痛对危重病人预后的影响。这一结果有力地证明了对疼痛的系统评价有助于降低ICU疼痛的发生率和强度,影响ICU疼痛的药理学治疗。然而,系统性疼痛评估对临床结果的影响,如生存期、住院时间和并发症,需要在适当动力的RCT中进一步评估。
参考文献
[1] Voigt L, Paice JA, Pouliot J. Standardized pain flflowsheet: impact on patient reported pain experiences after cardiovascular surgery. Am J Crit Care 1995 Jul;4(4):308e13. an offificial publication, American Association of Critical-Care
Nurses.
[2] Hazinski MF, Nolan JP, Billi JE, et al. Part 1: Executive summary: 2010 international consensus on cardiopulmonary resuscitation and emergency cardiovascular care science with treatment recommendations. Circulation 2010;122:S250–75.
[3] Stanley K. Design of randomized controlled trials. Circulation 2007;115:1164–9.
[4] Barr J, Fraser G, Puntillo K, Ely E, Gelinas C, Dasta J, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med 2013;41(1):263e306.
[5] Kastrup M, Von Dossow V, Seeling M, Ahlborn R, Tamarkin A, Conroy P, et al. Key performance indicators in intensive care medicine. a retrospective matched cohort study. J Int Med Res 2009 Oct;37(5):1267e84.
[6]欧文·罗伊·约翰,莱斯莉·S·普利凯普, 埃米尔·希斯格尔.用于疼痛检测和疼痛量化指数计算的系统和方法[P].美国,CN 10167775A,2008.10.16:2.
[7]陈祢,李超,郭铁成等.健康人压痛阈特点的初步研究[J].中国康复医学杂志,2010, 25(9): 858-863.
[8] 杨敏, 姚树桥, 张长杰. 痛阈的检测及影响因素[J].中国康复理论与实践
, 2009, 15(7): 603-605.
[9] Elliott D, Aitken LM, Bucknall TK, Seppelt IM, Webb SA, Weisbrodt L, et al. Patient comfort in the intensive care unit: a multicentre, binational point prevalence study of analgesia, sedation and delirium management. Crit Care Resusc 2013;15(3):213e9.
[10] 丁超,孙莉.电刺激镇痛研究进展[J].麻醉与监护论坛,2004, 11(6):421-423.
[11] 徐惠芳,张晓丽,金 林,等.芬太尼透皮贴剂的镇痛效果和对心率变异性及机体应激状态的影响[ J].中华麻醉学,2001,21(3):153-156.