中核建中核燃料元件有限公司 四川宜宾 644000
摘要:文章研究建立了使用PNH3-1型氨气敏电极测量铀化合物及铀钆混合氧化物中氮含量的方法。针对氨气敏电极的特性要求,对电极响应时间、溶液温度、离子强度调节剂等分析参数进行了优化选择,采用氮蒸馏装置将试样中的氨与铀基体及杂质元素分离,消除了共存金属离子的干扰,相比ISO 9006:1994中采用的标准加入-氨气敏电极法、GB/T11843-89中采用的奈氏勒-分光光度法测定氮含量,方法更加环保、快速和经济。
结果表明:当称样量为0.5g时,氮含量测定范围为(8~200)μg/g,方法回收率为(86~118)%,相对标准偏差优于9%。
关键词:氨气敏电极 氮 蒸馏装置
Ammonia gas sensitive electrode measure nitrogen content of uranium compounds and uranium gadolinium oxide
Wang Kun Shen Huihui
CNNC Jianzhong Nuclear Fuel Co., Ltd SiChuanYiBin 644000
Abstract:In this paper, a method to measure the nitrogen content in uranium compounds and uranium gadolinium oxide with PNH3-1 ammonia gas sensitive electrode was established. According to the requirement of the feature of electrode, optimal selection for the parameters, such as responds time, solution temperature, ISA and so on were carried out. The nitrogen in the sample was separated from uranium matrix and impurity elements with a nitrogen distilling plant, that can eliminate the interference of metal ion. In contrast to ISO 9006:1994 and GB/T11843-89, the method is environment protection, speediness and economics. Results display: the sample weight is 0.5g, the determination range of nitrogen is (8~200)μg/g, the recovery is (86~118)%,and the relative standard deviation is better than 9%.
Keyword: ammonia gas sensitive electrode, nitrogen, distilling plant
在核燃料元件制造过程中,对二氧化铀芯块、粉末及含钆二氧化铀芯块的氮含量都有严格的规定,为满足二氧化铀芯块、粉末及含钆二氧化铀芯块中氮含量的技术要求,需要对其进行分析检测。
通过文献调研,测定氮含量的方法有很多,主要为凯氏定氮法[1]、奈氏勒-分光光度法[2]、氨气敏电极法[3]及惰气熔融-红外吸收热导法[4-6]、甲醛滴定法[7]、过硫酸钾消化法[8-9]等。测定含铀样品中氮含量的方法主要有奈氏勒-分光光度法、氨气敏电极法及惰气熔融-红外吸收热导法。目前测定铀化合物及铀钆混合氧化物中氮的含量大多采用的是奈氏勒-分光光度法[10-11],使用到的氯化汞为剧毒有害物质,为了减少剧毒品德使用,有必要建立一种新的测定氮含量的方法。将原有国际标准ISO 9006:1994[12]方法基础与公司现有测氮方法的先进经验和蒸馏装置结合,既用盐酸和过氧化氢溶解铀化合物及铀钆混合氧化物,利用现有氮蒸馏装置蒸馏得到馏出液,采用氨气敏电极测其氮含量。
该法的建立既摆脱了现有测氮方法必须使用剧毒有害物质的束缚,符合低碳清洁环保的要求,采用氮蒸馏装置将试样中的氨与铀基体及杂质元素分离,消除了共存金属离子的干扰。
1 试验部分
1.1 设备
1.1.1 氨气敏电极,PNH3-1型(见图1);
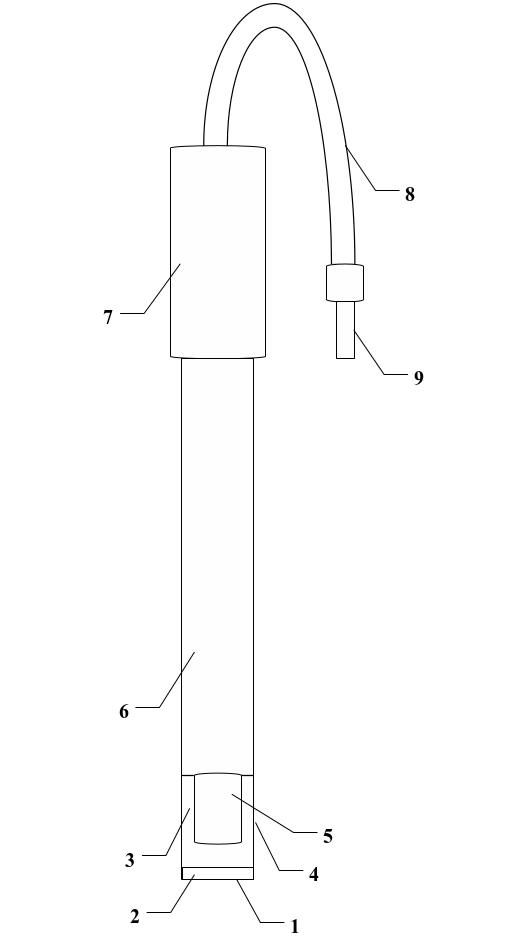
1-透气薄膜;2-硅橡胶垫圈;3-内溶液;4-电极外壳前帽;5-内电极;
6-电极外壳;7-电极外壳后帽;8-电极导线;9-电极插头
图1 PNH3-1型氨气敏电极示意图
1.1.2 氮蒸馏装置(见图2);
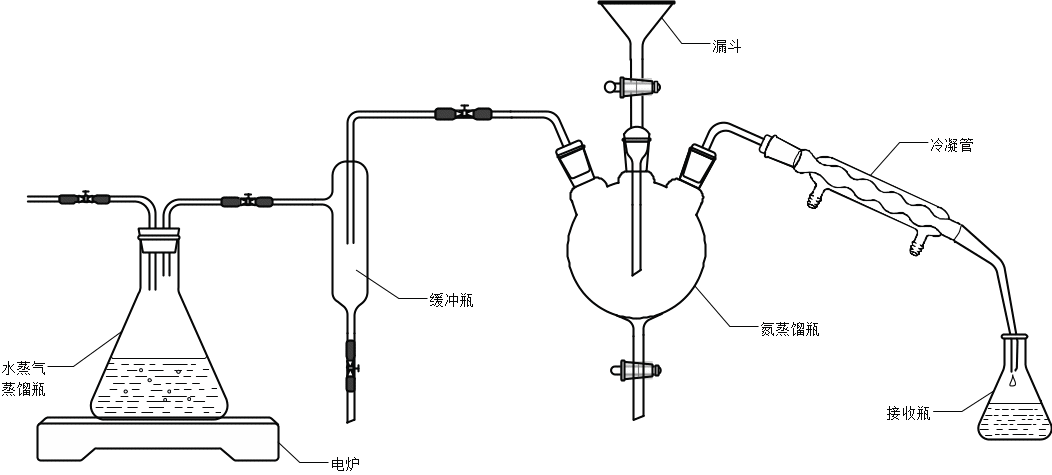
图2 氮蒸馏装置示意图
1.2 试验方法
1.2.1 标准曲线的绘制
分别移取0.1mL、0.2 mL、0.5 mL、1.0 mL氮标准溶液[13]于四个50mL容量瓶中,分别加入1mL氢氧化钠溶液(0.5mol/L),以氨气敏电极为指示电极,读取平衡电位值E。以电位值E为纵坐标、氨浓度的对数lgC为横坐标绘制标准曲线。
1.2.2 分析步骤
称取试样0.5g,加入1mL盐酸、2mL过氧化氢,加热溶解试样,当不再有气泡冒出时取下冷却。将溶解好的试样溶液转移至氮蒸馏装置,加入25mL氢氧化钠溶液(500g/L),通过蒸馏接收(20~40)mL蒸馏液于50mL容量瓶内。在上述接收液中加入1mL氢氧化钠溶液(0.5mol/L),定容摇匀。以氨气敏电极为指示电极,读取平衡电位值E。根据绘制的标准曲线可查得对应的氨浓度C1,计算得到m1。
1.3 分析结果计算
用公式(1)计算含铀样品中氮的质量分数。
![]() ……………………………… (1)
……………………………… (1)
式中:
w––样品中氮的质量分数,μg/g;
m1––样品试液中测得氮的质量,m1=50C1(C1为样品溶液氨浓度,μg /50mL),μg;
m0––空白试液中测得氮的质量,m0=50C0(C0为空白溶液氨浓度,μg /50mL),μg;
m––铀化合物及铀钆混合氧化物的样品质量,g。
2结果与讨论
2.1 氨气敏电极测量原理
氨气敏电极是一种复合式离子选择性电极,以pH玻璃电极为指示电极,Ag-AgCl电极为参比电极。当样品溶液的pH值大于11时,使溶液中的铵盐转化为氨,生成的游离氨由于扩散作用通过气敏膜(其它离子则不能通过),氨气进入内充液中进行如下化学反应:
![]()
反应向右进行,OH—离子浓度改变了内充液的pH值,由pH玻璃电极测其变化。pH的变化与NH3气的浓度成线性关系,由此可以通过测定的电位值,确定样品中的总氮含量。
2.2 电极性能对测量结果的影响
2.2.1 电极响应时间的影响
电极响应时间与被测溶液中铵离子的浓度成反比,溶液浓度越低电极响应时间越长,而响应时间的延长,可能会造成氨被空气吸收造成测量误差,因此需确定电极的最佳响应时间。电极响应时间主要由溶液均匀性和电极平衡两个参数决定。
2.2.1.1确定最佳搅拌时间
分别对10μg/50mL和100μg/50mL的氮标准溶液的搅拌时间进行研究,平衡3min后,记录不同搅拌时间对应的电位值,结果见表1。
表1搅拌时间对测定结果的影响
搅拌时间(s) | 30 | 60 | 90 | 120 | 150 | 180 | 300 | 600 |
10μg氮 电位值(mV) | -41.5 | -44.6 | -45.1 | -45.4 | -45.5 | -45.5 | -45.6 | -45.6 |
100μg氮 电位值(mV) | -109.5 | -110.3 | -110.5 | -110.6 | -110.7 | -110.7 | -110.7 | -110.8 |
由表1可以看出,对于10μg/50mL的氮标准溶液搅拌2min电位值基本稳定,对于100μg/50mL的氮标准溶液搅拌1.5min电位值基本稳定。在既能保证获得最佳的试验结果,又能提高检测效率的条件下,最佳搅拌时间为(2~4)min。
2.2.1.2 确定最佳平衡时间
分别对10μg/50mL和100μg/50mL的氮标准溶液的平衡时间进行研究,搅拌3min,记录不同平衡时间的电位值,结果见表2。
由表2可以看出,铵离子浓度愈高,平衡的时间愈短,铵离子浓度愈低,平衡时间愈长。确定最佳平衡时间为(2.5~5)min。
表2平衡时间对测定结果的影响
平衡时间(s) | 30 | 60 | 90 | 120 | 150 | 180 | 300 | 600 |
10μg氮 电位值(mV) | -38.6 | -42.6 | -44.1 | -45.0 | -45.5 | -45.5 | -45.6 | -45.6 |
100μg氮 电位值(mV) | -108.4 | -109.9 | -110.4 | -110.6 | -110.6 | -110.7 | -110.7 | -110.7 |
2.2.2 温度的影响
氨气敏电极是一种电化学传感器,温度变化会影响电极斜率。根据氨敏电极温度补偿系数,当溶液浓度为10-3mol/L时,温度每改变1℃会造成2%的误差。
本方法中氮含量测量范围最高为200μg/g,即对应待测液的浓度测量范围最高为0.143×10-3mol/L,虽远小于10-3mol/L,但仍需考查温度对待测液氮含量测定结果的影响。在不同温度(7℃、23℃、28℃、35℃、43℃)下进行标准曲线的绘制,其结果见图3。
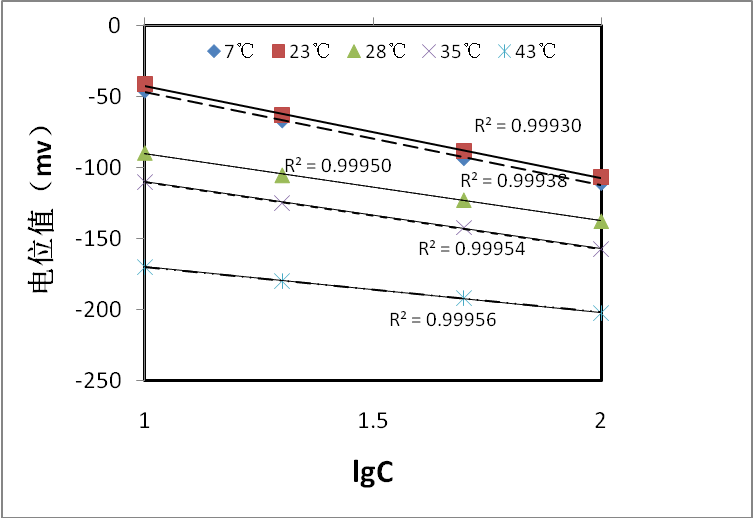
图3 不同温度下(7℃、23℃、28℃、35℃、43℃)待测液的氮标准曲线
由图3可知,5条标准曲线的相关系数均大于0.99,温度分别为7℃、23℃的两条标准曲线基本重合,说明温度低于室温对测量结果影响很小。当温度超过23℃,随着温度的升高,同一浓度的待测液电位值均明显降低。同时,当温度超过35℃,由于与室温温差较大,待测液在测量过程中温度会逐渐降低,需要的相应时间也就越长,带来的误差也就越大。由此可知,最佳测量温度范围为7~35℃;在测量过程中,标准溶液与待测液温度应一致。
2.2.3 共存离子干扰的影响
在国际标准ISO 9006:1994(E)中提到了在分析检测时,向待测溶液中加入一定浓度的EDTA-2Na和K2CO3混合液,其中,加入EDTA-2Na溶液的作用是减少离子强度变化对测定结果的影响,消除某些金属离子的干扰。值得注意的是,本试验方法增加了待测液与铀基体及杂质的分离过程,待测液为利用氮蒸馏装置蒸馏得到的馏出液,其中不含有金属离子,因此也就直接消除了金属离子对测量结果的影响。
2.3离子强度调节剂的选择
本着在既能准确检出待测液氮含量,又能使加入的缓冲溶液种类及用量最少,起到节能减排的作用原则,试验设计为两部分:确定缓冲溶液种类;确定缓冲溶液浓度。
2.3.1 缓冲溶液种类的确定
在三种不同类别的缓冲溶液:(a)等量的去离子水;(b)一定量的NaOH溶液;(c)一定量的NaOH及EDTA-2Na混合液中选择其一,分别称取三个0.5g氮含量已知(N≤10μg/g)的芯块样品,并分别加入0.2mL氮标准溶液,进行测定,考查其氮含量及回收率,其试验结果见表3。
表3不同类别的缓冲溶液测定结果
缓冲溶液类别及用量 | 基体氮含量(μg/g) | 加入氮含量 (μg/g) | 氮含量测定值 (μg/g) | 回收率 (%) |
1mL去离子水 | 7.6 | 40 | 0.71 | ------ |
1mL(1mol/L NaOH)溶液 | 49.61 | 105.02 | ||
1mL(1mol/L NaOH+0.1mol/L EDTA-2Na)溶液 | 47.15 | 98.88 |
由表3可看出,加入(a)溶液的测定结果与实际值偏差很大,这是因为加入的缓冲溶液使待测液PH<11,待测液中的铵根离子不能及时的与氢氧根离子反应,不符合测定要求;加入(b)、(c)溶液的测定结果与实际值都较为接近,回收率分别为105.02%、98.88%,符合测定要求,NaOH溶液的加入使待测液PH>11,且本试验过程中待测液与铀基体及杂质的已分离,无金属离子干扰测定。因此选择NaOH溶液作为缓冲溶液。
2.3.2 缓冲溶液浓度的确定
当确定NaOH溶液作为缓冲溶液后,还需确定其浓度。缓冲溶液的浓度高低直接影响其PH值。当待测液为PH=11、PH=14时对应NaOH溶液的浓度应为0.05 mol/L、50mol/L(NaOH溶液加入量为1mL)。将NaOH溶液分成浓度为0.05 mol/L和50 mol/L两种类型,进行测定,考查标准曲线的相关系数,其试验结果见表4。
表4 不同浓度的缓冲溶液测定结果
缓冲溶液浓度 | 相关系数R |
1mL0.05 mol/LNaOH溶液(PH=11) | -0.99896 |
1mL50 mol/LNaOH溶液(PH=14) | -0.99963 |
由表4可知,分别加入两种浓度的NaOH溶液,其标准曲线的相关系数均在0.99以上,均满足使用要求,为了确保待测液PH>11,将NaOH溶液浓度为0.5mol/L(即PH=12)作为缓冲溶液的浓度。
2.4 标准曲线与工作曲线的比较与检验
2.4.1 标准曲线绘制
按照试验方法1.2.1进行,见图4所示。
2.4.2 工作曲线绘制
分别称取四个0.5g氮含量已知(N≤10μg/g)的芯块样品,分别加入0.1mL、0.2mL、0.5mL、1.0mL氮标准溶液,测定结果见图4所示。
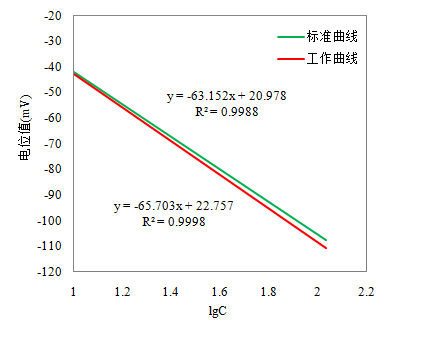
图4 氮标准曲线与工作曲线的比较
以F检验和t检验对各元素的标准曲线与工作曲线进行检验[14-15]:
由回归方程y=a+bx,回归直线上的点(x1,y1),(x2,y2)……(xi,yi),计算各统计量如下:
标准曲线和工作曲线的回归标准偏差:
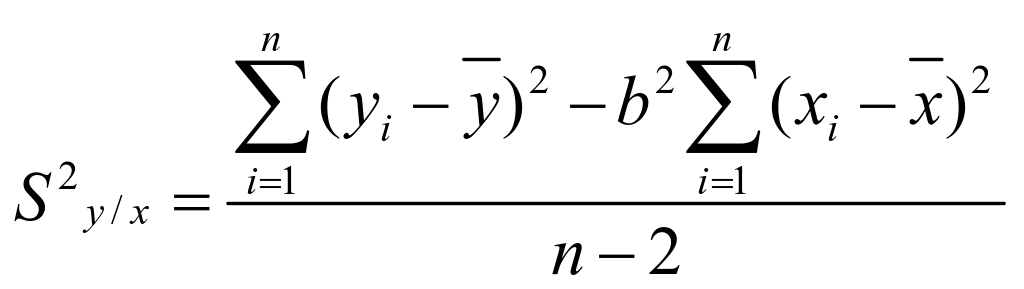 …………………… (2)
…………………… (2)
检验标准曲线和工作曲线方差之间有无显著性差异:
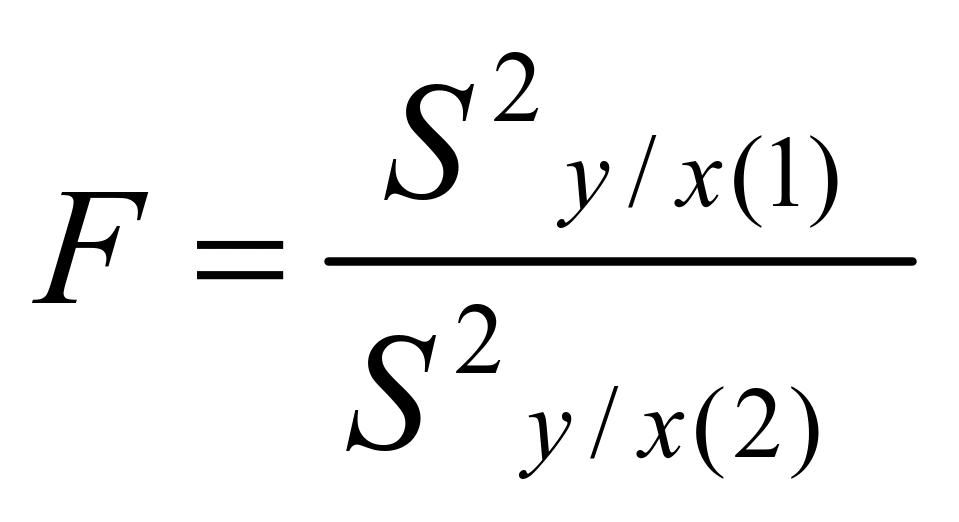 …………………………… (3)
…………………………… (3)
组合方差公式:
![]() 2y/x=[(n1-2)S2y/x(1)+(n2-2) S2y/x(2)]/(n1+n2-4) …………………… (4)
2y/x=[(n1-2)S2y/x(1)+(n2-2) S2y/x(2)]/(n1+n2-4) …………………… (4)
两条曲线的斜率之间方差:
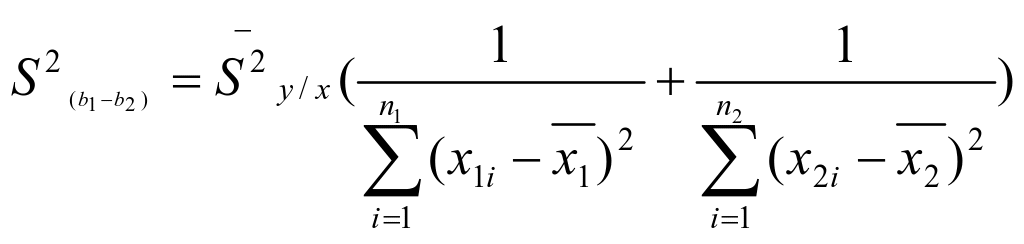 ……………… (5)
……………… (5)
两条曲线的截距之间方差:
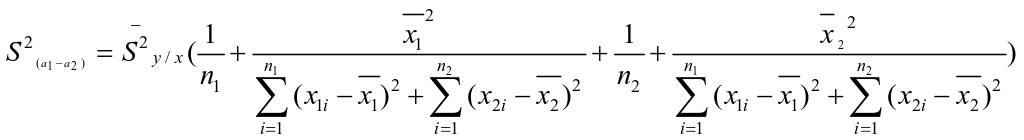 …… (6)
…… (6)
检验两条曲线斜率之间有无显著性差异:
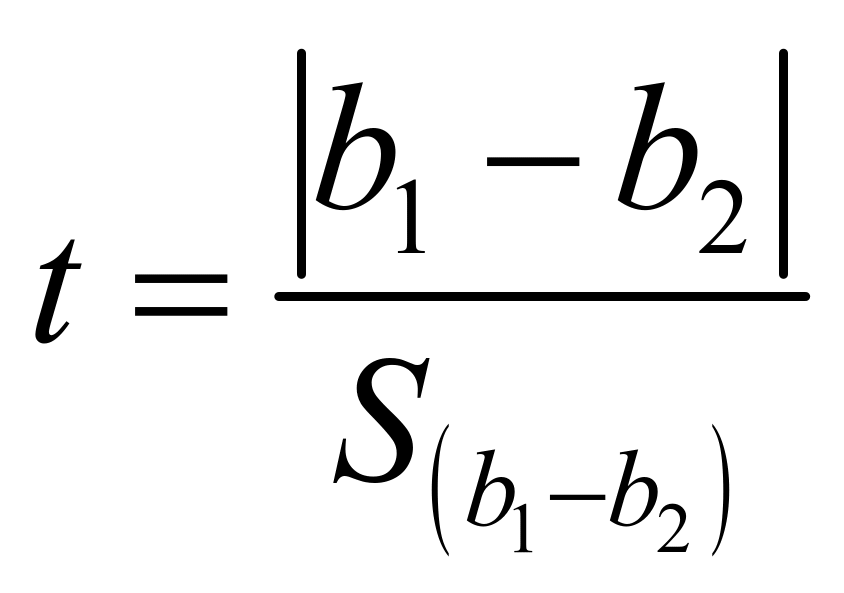 …………………………… (7)
…………………………… (7)
检验两条曲线截距之间有无显著性差异:
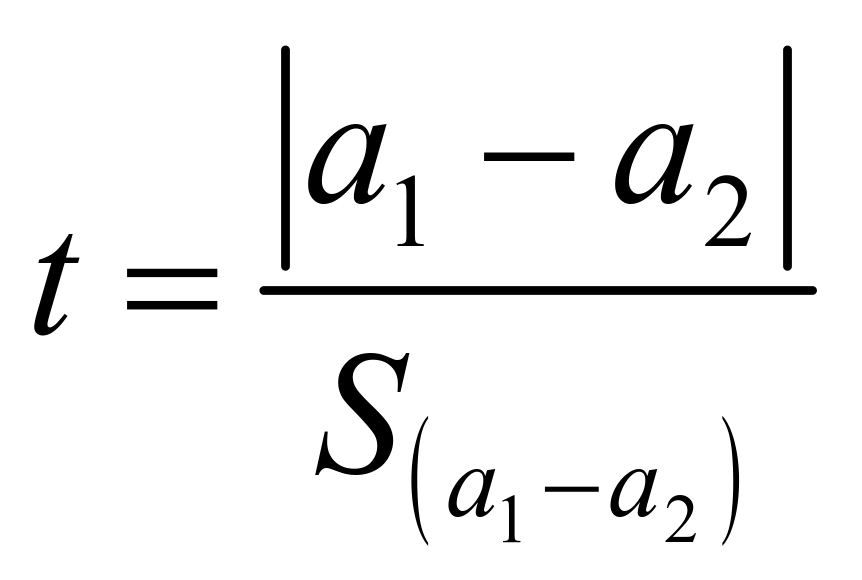 …………………………… (8)
…………………………… (8)
计算得的各值见表5。
表5 标准曲线与工作曲线比较
检验项目 | | F检验 | | | | t检验 |
N标准曲线 | 1.443 | | 0.888 | 1.903 | 2.135 | t斜=1.340.05,4=2.78 t截=0.830.05,4=2.78 |
N工作曲线 | 0.133 |
由表6可看出,选择置信度为95%时,氮标准曲线与工作曲线不存在显著性差异。因此,本方法采用标准曲线进行样品分析。
2.5 方法定量检测下限的确定
连续测定20个样品的氮含量,算出其标准偏差,以10倍标准偏差作为方法的定量检出限,结果见表6。
表6 方法定量检测下限测定结果(μg)
20次测定结果 | 平均值 | 标准偏差(S) | 检测下限(10S) |
3.25 2.98 2.41 2.88 3.74 3.47 2.87 2.75 3.58 4.13 2.96 3.04 3.35 3.64 2.98 3.48 2.95 3.15 3.34 3.22 | 3.208 | 0.396 | 3.96 |
由表6可知,当样品称样量为0.5g时,方法的定量检测下限为8μg/g。
2.6 方法回收率与精密度试验
分别选取同一批次、低含量的二氧化铀芯块及粉末样品13个,其中1个作为基体,6个分别加入0.1mL氮标准溶液,6个分别加入1.0mL氮标准溶液,其回收率及相对标准偏差测定结果见表7。
表7 二氧化铀芯块及粉末回收率及相对标准偏差测定结果
基体含量 (μg/g) | 加入量 (μg/g) | 测定量 (μg/g) | 回收量 (μg/g) | 回收率 (%) | 平均值 (μg/g) | RSD (%) |
二氧化铀芯块样品 (基体含量为6.31μg/g) | 20.00 | 26.06 | 19.75 | 98.75 | 21.08 | 8.06 |
26.72 | 20.41 | 102.05 | ||||
28.93 | 22.62 | 113.10 | ||||
29.82 | 23.51 | 117.55 | ||||
25.41 | 19.10 | 95.50 | ||||
27.39 | 21.08 | 105.40 | ||||
二氧化铀芯块样品(基体含量为6.31μg/g) | 200.00 | 180.01 | 173.7 | 86.85 | 182.30 | 3.96 |
183.16 | 176.85 | 88.43 | ||||
184.21 | 177.90 | 88.95 | ||||
191.79 | 185.48 | 92.74 | ||||
198.50 | 192.19 | 96.10 | ||||
194.00 | 187.69 | 93.85 | ||||
二氧化铀粉末样品 (基体含量为12.5μg/g) | 20.00 | 32.24 | 19.74 | 98.70 | 20.77 | 6.52 |
31.49 | 18.99 | 94.95 | ||||
32.84 | 20.34 | 101.70 | ||||
33.65 | 21.15 | 105.75 | ||||
34.23 | 21.73 | 108.65 | ||||
35.19 | 22.69 | 113.45 | ||||
二氧化铀粉末样品 (基体含量为12.5μg/g) | 200.00 | 195.37 | 182.87 | 91.44 | 195.96 | 4.34 |
207.16 | 194.66 | 97.33 | ||||
202.89 | 190.39 | 95.20 | ||||
215.33 | 202.83 | 101.42 | ||||
218.46 | 205.96 | 102.98 | ||||
211.57 | 199.07 | 99.54 |
由表7可知,在称样量为0.5g时,方法回收率在86%~118%范围内,相对标准偏差为8.1%。
2.7 本方法与国家标准方法的比对试验
分别称取0.5g同一批次二氧化铀粉末样品12个(因高温烧结后的二氧化铀芯块氮含量低于检测下限,此处选取粉末样品),按国家标准方法GB/T11843-89分析6个,本方法分析6个,结果见表8。
表8 比对试验结果(μg/g)
比对方法 | 测定结果 | 平均值 | S |
本方法 | 19.05 23.05 21.08 22.35 20.68 18.85 | 20.84 | 1.698 |
GB/T11843-89 | 18.94 20.09 20.94 21.98 19.70 21.60 | 20.54 | 1.169 |
方差检验 | | ||
平均值检验 | | ||
由表8可知,采用本方法与国家标准方法GB/T11843-89测定二氧化铀样品中的氮含量,不存在显著性差异。
3 结论
(1)本方法适用于铀化合物及铀钆混合氧化物中氮含量的测定。当称样量为0.5g时,测定范围为(8~200)μg/g,满足有关技术条件要求。
(2)本方法回收率在86%~118%范围内,相对标准偏差优于9%。
(3)本方法的建立摆脱了分光光度法长期依赖剧毒有害物质的束缚,解决了含汞溶液的使用管理和废液的处理问题,符合低碳清洁环保的要求,消除了共存金属离子的干扰,相比ISO 9006:1994中采用的标准加入—氨气敏电极法、GB/T11843-89中采用的奈氏勒分光光度法测定氮含量,方法更加环保、快速和经济。
参考文献
陈智慧等.用凯氏定氮法测定食品中的蛋白质含量.新疆畜牧业,2008(5):22-24.
崔家荣.水中氨氮纳氏试剂分光光度法测定.现代农业科技,2008(8):208-209.
蔡杰等.氨气敏电极法测定大气中氮.上海环境科学,2000(3):137-140.
孙金库等.红外吸收法和热导法测定铀钼合金中氧和氮.冶金分析,2010,30(5):6-8.
钟华.惰气熔融—热导法测定氮化铬铁中氮.冶金分析,2010(3):64-67.
武红英等.脉冲熔融热导法测定铀铌合金氮含量的研究.稀有金属与硬质合金.2011(12):66-69.
林元藻等.生化制药学[M].北京:人民卫生出版社,1998.
王毛兰等.碱性过硫酸钾测定水质总氮的影响因素[J].光谱实验室,2006 23(5):1046-1049.
彭建平等.海藻总氮含量测定方法研究[J].海洋环境科学,2009(28):72-75.
GB/T 11843-1989.二氧化铀粉末和芯块中氮的测定 分光光度法.
EJ/T 1212.8-2008.烧结氧化钆-二氧化铀芯块分析方法 第8部分:蒸馏奈氏勒试剂光度法测定氮.
ISO 9006:1994(E).Uranium metal and uranium dioxide powder and pellets- Determination of nitrogen content-Method using ammonia-sensing electrode.
QCL02174 核燃料杂质测定用标准溶液的制备.中核建中核燃料元件有限公司内部资料.
漆德瑶等.理化分析数据处理手册.北京:中国计量科学出版社,1990.
全浩主编.标准物质及其应用技术.中国标准出版社,1990.
作者简介:汪昆(1986—),男,汉,重庆人,硕士研究生,工程师,研究方向为核化学分析检测领域。
11