厦门大学附属翔安医院医学检验科 361100
摘要 目的:通过西门子Viva-E全自动药物分析仪(Siemens Viva-E)和雅培ARCHITECT i2000SR全自动免疫分析系统(Abbott ARCHITECT i2000SR)对免疫抑制剂他克莫司血药浓度进行检测,分析两种仪器的精密度、准确性、一致性。方法:分别采用Siemens Viva-E(酶免疫增强放大法)和Abbott ARCHITECT i2000SR(化学发光微粒免疫分析方法)分别测定低、中、高3个水平昆莱室内质控品,分析仪器的精密度;分别测定2021卫生部临床检验中心提供的室间质量评价质控品,以液相色谱串联质谱联用仪(LC-MS)测定法为参考方法,分析两种方法与其的相关系数,评价检测结果的准确性;分别测定672份他克莫司谷浓度临床标本,分析不同方法学的一致性。结果:室内质控品在Abbott ARCHITECT i2000SR变异系数较较Siemens Viva-E低,但在低、中浓度水平p>0.05,无统计学差异,在高浓度水平p<0.05,差别有统计学意义;室间质控品测定结果与参考方法相比相关系数良好,均>0.99;临床标本测定结果显示两种仪器检测数据一致性良好,P>0.05,没有统计学差异。结论:目前临床实验室常用的Siemens Viva-E和Abbott ARCHITECT i2000SR在测定他克莫司血药浓度水平上没有明显的统计学差异,但是在高浓度室内质控品,Abbott ARCHITECT i2000SR较Siemens Viva-E变异系数小,精密度高。
关键词:他克莫司 质控品 Siemens Viva-E Abbott ARCHITECT i2000SR
他克莫司是从土壤微生物中分离提纯所获得的一种大环内酯类免疫抑制剂[1],属于钙调磷酸酶抑制剂中的一种[2],是临床上用于肾脏、肝脏和心脏等各种实体器官移植术后的一线免疫抑制剂[3],还应用于自身免疫性疾病的治疗,比如自身免疫性红斑狼疮、类风湿性关节炎等[4]。 临床上通过长期监测血液他克莫司浓度以指导临床用药剂量,本文对Siemens Viva-E和 Abbott ARCHITECT i2000SR仪器进行性能评价。
1 资料与方法
1.1 一般资料
收集2018年11月至2020年12肾移植术后于本院进行他克莫司药物检测随访EDTA-K2抗凝全血标本672份。其中男性420例,女性252例。在进行标本检测前进行室内质控品检测,并记录低、中、高3个水平浓度结果各52批次;检测2011年卫生部临床检验中心室间质量评价质控品并记录结果。
仪器与试剂
1.2.1 德国西门子公司生产的Siemens Viva-E采用酶放大免疫检测法,试剂采用原装Siemens Emit®200他克莫司测定试剂及配套标准品。
1.2.2 美国雅培公司生产的Abbott ARCHITECT i2000SR采用化学发光微粒子免疫检测法,试剂采用原装雅培他克莫司测定试剂及配套标准品。
1.2.3室内质控品均由上海昆莱生物有限公司提供,室间质量评价质控品由卫生部临床检验中心提供。
1.3操作步骤
1.3.1 取待测标本于1.5ml离心管中,再取200µl甲醇和50µl样本预处理液(硫酸铜)于离心管中,立即充分混匀,在旋涡混匀器上震荡30s,静置2min,充分萃取他克莫司,12000g离心5min,将离心的上清液倒入测定管,通过Siemens Viva-E检测。
1.3.2 取待测标本于1.5ml离心管中,再取200µl前处理液于离心管中,立即立即充分混匀,在旋涡混匀器上震荡30s,静置2min,充分萃取他克莫司,12000g离心5min,将离心的上清液倒入含有EDTA-K2专用测定管,通过Abbott ARCHITECT i2000SR检测。
1.4 本研究采用spss13.0统计学软件分析,数值以均数±标准差表示,精密度和一致性分析采用配对T检验,以p≤0.05认为差异具有统计学意义;准确性采用相关系数分析,以r2>0.99为相关性良好。
结果
2.1 用昆莱室内质控品验证仪器精密度,低、中浓度水平Abbott ARCHITECT i2000SR测定结果为4.87±0.58和18.92±1.92,变异系数为12.80和10.15较Siemens Viva-E测定结果为4.53±0.62和18.53±1.94,变异系数为13.62和10.47,差别无统计学差异(p>0.05)。在高浓度水平测定结果为22.37±3.32和20.91±3.48,其变异系数为14.84和16.64,差别有统计学差异(p<0.05)。如表1。
表1 两种方法学的精密度比较
浓度水平 | 个数 | 检测仪器 | 均数±标准差(ng/ml) | CV% | P |
低水平 | 52 | Siemens Viva-E Abbott ARCHITECT i2000SR | 4.53±0.62 4.87±0.58 | 13.69 12.80 | P>0.05 |
中水平 | 52 | Siemens Viva-E Abbott ARCHITECT i2000SR | 18.53±1.94 18.92±1.92 | 10.47 10.15 | p>0.05 |
高水平 | 52 | Siemens Viva-E Abbott ARCHITECT i2000SR | 20.91±3.48 22.37±3.32 | 16.64 14.84 | P<0.05 |
2.2 卫生部临床检验中心提供的室间质量评价质控品检测结果显示Siemens Viva-E所测浓度水平均较Abbott ARCHITECT i2000SR和液相色谱串联质谱联用仪(LC-MS)检测结果为低;如果以液相色谱串联质谱联用仪(LC-MS)检测法为参考方法,将Siemens Viva-E和 Abbott ARCHITECT i2000SR与之相比,相关系数分别为0.997和0.998,相关系数良好(r2>0.995)。如表2,图1。
表2 卫生部室间质控品检测结果
仪器 | 202111 | 202112 | 202113 | 202114 | 202115 | 相关系数r2 |
Siemens Viva-E | 5.4 | 11.1 | 7.8 | 2.4 | 10.3 | 0.997 0.998 |
液相色谱串联质谱联用仪(LC-MS) | 6.6 | 12.8 | 8.8 | 3.6 | 11.2 | |
Abbott ARCHITECT i2000SR | 7.3 | 13.6 | 9.2 | 3.5 | 12.2 |
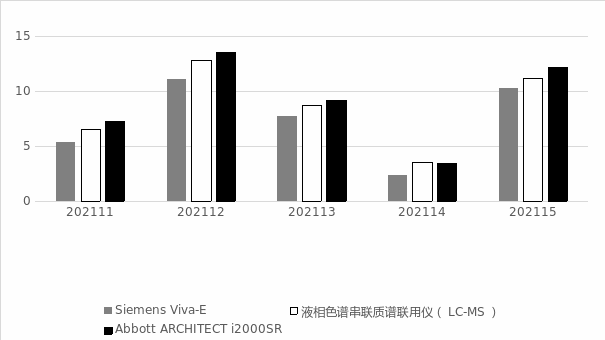
图1 2021年卫生部质控结果
说明:高效液相串联质谱(LC-MS)数据来自卫生部临床检测中心网站
2.3 672份EDTA-k2抗凝全血临床标本,其中男性420例,平均年龄为45.33±8.72岁,女性252例,平均年龄为41±5.88岁。标本经两种检测方法所测得数据进行统计学分析,没有统计学差异(P>0.05)。详见表3。
表3 672份临床样本检测结果
总例次 | 仪器 | 均数±标准差 | CV | p |
672 | Siemens Viva-E | 7.69±4.09 | 0.53 | 0.68 |
Abbott ARCHITECT i2000SR | 8.00±3.89 | 0.49 |
4 讨论
他克莫司是临床常用一线免疫抑制剂[2-4],通过与FK-506结合蛋白家族结合,抑制钙调磷酸酶活性,使活化的T细胞因子脱磷酸过程受到抑制,从而抑制T细胞的增殖和功能
[3-4]。它是一种强效免疫抑制剂,比传统抑制剂环孢霉素药效作用大近100倍,但由于其治疗窗狭窄,毒副作用大,个体间药物浓度差别大[3],因此进行临床血药浓度监测,制定个体化用药方案可以提要用药效率。
目前临床上用于他克莫司药物浓度检测的方法主要包括酶联免疫吸附(Enzyme-linked immunosorbent assay,ELISA)、酶放大免疫检测(Enzyme multiplied immunoassay technique,EMIT)、化学发光微粒子免疫检测(Chemiluminesent microparticle immunoassay,CMIA)、电化学发光免疫分析(Electrochemiluminescent immunoassay,ECLIA)、高效液相串联质谱(LC-MS)等方法[5-10]。随着临床对药物浓度结果的依赖性,酶联免疫吸附方法特异性、敏感性较低,检测时间长,一般需要4-6小时,该方法已经被临床淘汰使用;高效液相串联质谱(LC-MS)仍然是检测免疫抑制药物浓度的金标准,其敏感度和特异性均较高[7],但其检测时间长,仪器昂贵,不适合临床实验室使用;电化学发光免疫分析是以罗氏公司生产的Cobase 411实现药物浓度检测,信号接收器通过测定标记在抗体上的化学发光剂三联吡啶钌信号变化进行浓度换算[8],但其检测试剂较昂贵,临床实验室较少使用该方法。基于检测方法的敏感性及特异性,检测结果的准确性、检测成本及检测时间等综合因素,以下2种方法是目前全国临床实验室常用的他克莫司血药浓度检测分析方法。酶免疫放大增强法是以Siemens Viva-E为代表,其原理是待测样品中的药物与试剂中已标记葡萄糖-6-磷酸脱氢酶(G-6-PD)的药物定量竞争抗体结合位点,通过测定吸光度的变化来反映样本中的浓度水平;化学发光微粒子免疫检测是以Abbott ARCHITECT i2000SR为代表,其检测原理是以测量吖啶酯标记物在碱性介质中发生化学反应所产生的光子量为基础,以类磁颗粒作为包被载体,其可提高反应的敏感性和特异性,缩短检测时间[9-11]。
本文通过测定昆莱室内质控品低、中、高3个水平、室间质控品和临床样本的检测结果均显示在目前实验室常用的检测仪器中,Siemens Viva-E测定结果较Abbott ARCHITECT i2000SR浓度略低;在室内质控品检测结果显示低、中水平浓度精密度没有统计学差异(p>0.05),在检测高浓度水平,Abbott ARCHITECT i2000SR变异系数较Siemens Viva-E,精密度高,具有统计学差异(p<0.05,表1)。但是临床患者他克莫司浓度治疗窗均在3-15ng/ml,对于中、高浓度质控品数据分析临床意义较小。在低、中水平室内质控、室间质评、临床样本数据分析均显示两种仪器在精密度、准确性、一致性上没有统计学差异(p>0.05,表1,表3),与参考方法的对比中,结果显示相关系数良好(r2>0.99,表2,图1)。目前临床检测方法众多,医院可能存在多种仪器和多种检测方法,由于服用免疫抑制剂他克莫司患者较多,其治疗窗狭窄,毒副作用等的相关因素,对于同一个患者尽量长期使用同一种仪器进行药物浓度监测,才能达到更好的临床治疗效果。
肾移植术后3个月是移植术后感染和急性排斥反应的高发期[2-4],肾移植术后常规使用钙调磷酸酶抑制剂他克莫司或者环孢霉素防止移植物丢失,他克莫司是临床首选抗排斥反应药物[13]。肾移植术后免疫抑制剂使用过量容易造成机体免疫功能低下机体发生感染风险率升高,肺部感染是移植术后常见并发症[14],其严重时会导致病人死亡,免疫抑制剂使用不足容易发生术后排斥反应造成移植器官失功[15],因此服用免疫抑制剂患者必须进行实验室长期监测,实验室提供正确的浓度结果可以为临床医师调整用药提供客观依据。
参考文献
[1]Pharmacokinetics,Pharmacodynamics and Pharmacogenetics of Tacrolimus in Kidney Transplantation[J]. Current Drug Metabolism,2018.
[2] Schwarz C,Mayerhoffer S, Berlakovich G A , et al. Long‐term outcome of belatacept therapy in de novo kidney transplant recipients – a case‐match analysis[J].Transplant International,2015,28(7):820-827.
[3] Qin X,Rui J,Xia Y,et al. Multi-center Performance Evaluations of Tacrolimus and Cyclosporine Electrochemiluminescence Immunoassays in the Asia-Pacific Region[J]. Annals of Laboratory Medicine,2018,38(2).
[4] Baumgart D C,Macdonald J K,Feagan B.Tacrolimus (FK506) for induction of remission in refractory ulcerative colitis.[J]. Cochrane Database of Systematic Reviews, 2008,16(3):CD007216.
[5]卢蕾,杨欣.酶放大免疫检测技术在监测他克莫司血药浓度中的应用[J].中国免疫学杂志, 2014,30(009):1294-1296.
[6] Kirubakaran R,Stocker S L,Hennig S,et al. Population Pharmacokinetic Models of Tacrolimus in Adult Transplant Recipients: A Systematic Review[J]. Clinical Pharmacokinetics,2020,59(9).
[7]李鹏飞, 刘丽宏, 马萍,等. LC-MS/MS法测定人全血中他克莫司的浓度及其在生物等效性试验中的应用[J]. 药物分析杂志, 2009, 029(002):237-242.
[8]曹爱霖,王学彬,王卓,等.他克莫司及其血药浓度检测方法研究进展[J].药学服务与研究,21(3):6.
[9]庄丽君,金岩.德灵Viva-E2000和雅培ARCHITECT-i1000SR测定他克莫司血药浓度的结果对比研究[J].中国医疗器械信息,2019,25(14):109-110.
[10]张丽萍,郝钦芳,刘元明,宋娜,张丹浩,李晓晨,谭坤,杨晓莉.酶增强免疫分析法与微粒子酶联免疫吸附法检测他克莫司药物浓度的结果对比研究[J].检验医学,2011,26(08):501-505.
[11]刘旭华.化学发光微粒子免疫法检测两种免疫抑制剂血药浓度研究[J].医药论坛杂志,2011(11):30-32.
[12]周霞,汤汝佳,贺希,高银杰,姚红,刘振文,王洪波,刘鸿凌.细胞色素P450对肝移植患者他克莫司应用影响的临床研究[J].肝脏,2021,26(07):779-782+791.
[13] Cheng F,Li Q,Wang J,et al. Effects and safety evaluation of Wuzhi Capsules combined with tacrolimus for the treatment of kidney transplantation recipients[J]. Journal of Clinical Pharmacy and Therapeutics,2021.
[14]卢映蓉,王家莹,吴云,段茹.肺移植术后早期他克莫司血药浓度及影响因素分析[J].中国医院药学杂志,2021,41(16):1670-1674.
[15] Francke M I, Hesselink D A,Li Y,et al. Monitoring the Tacrolimus Concentration in peripheral bLood mononuclear cells of Kidney Transplant Recipients[J]. British Journal of Clinical Pharmacology, 2020.
基金项目:厦门市医疗卫生指导性项目(35022Z20209106)