浙江晟格生物科技有限公司,浙江省金华市321000
摘要:核糖及其衍生物脱氧核糖是核酸的重要组成部分,也是某些维生素及辅酶的成分。D-核糖及衍生物以呋喃型广泛存在于天然化合物中,而D-核糖的对映体L-核糖在自然界不存在,一般只能通过合成的方法得到。近年来,L-核糖及衍生物在医药中的应用报道日益增加。其原因是L-核糖核苷具有显著的抗病毒活性,而毒性却比D-核糖核苷低,其中,1-氧-氟基-2,3,5-三氧苯甲酰基-L-核糖是合成脱氧核糖核苷的重要中间体。然而,现有的工艺在制备过程中,其各个过程产物收率较低,因此需要研究出更合适的制备工艺,通过使用效益更高的催化剂来实现产物收率的提高。
关键词:L-核糖,催化剂,生物糖技术
前言
近年来,L-核糖及衍生物在医药中的应用报道日益增加。其原因是L-核糖核苷具有显著的抗病毒活性,而毒性却比D-核糖核苷低。一些L-核糖及衍生物2-脱氧-L-核糖与腺嘌呤等有机碱形成的核苷衍生物在癌症、乙肝等疾病的治疗方面具有极大的应用潜力。因此L-核糖及衍生物脱氧核糖的合成,是一个在有机合成中富有挑战性的课题。1然而,现有的工艺在制备过程中,其各个过程产物收率较低,如制备1-氧-乙酰基-2,3,5-三氧苯甲酰基-β-L-呋喃核糖的生产工艺,一般采用的经甲基化-苯甲酰基化-乙酰化反应制得,其三步总收率只在60%左右。此外,催化剂是提高生物糖收率的重要添加剂,目前存在一种采用-SO42-/SiO2-Al2O3/La3+固体酸催化剂,但是此类固体酸催化剂存在的问题在于比表面积小,降低了催化活性,或者是含硫基团易流失,活性失效快,重复性差。因此,若是要提高L-核糖及衍生物脱氧核糖的制备效益,必须在反应过程中利用更高比表面积的催化剂,提高产物收率。
1.L-核糖
核糖是一种典型的五碳糖,是各种核糖核酸、核苷酸辅酶以及ATP、NADP的组成成分,与生物遗传关系密切,对生物体的生理活性具有重要的调控作用。自然界中的核糖主要以D-核糖形态存在,以呋喃糖型广泛存在于植物和动物细胞中。L-核糖是与D-核糖相对的手性对映异构体,其分子结构见图1,在自然界和生物体内并不存在,是极为昂贵的稀有糖类。纯净的L-核糖是白色晶体或白色晶体粉末,带有甜味,可溶于水、乙醇、甲醇,不溶于乙醚、苯和丙酮。L-核糖是重要的药物合成中间体,可用于合成具有抗病毒活性的核苷类化合物,在抗艾滋病、抗病毒中间体方面显示强大的潜能。L-核糖经还原脱氧水解等加工还可生产2-脱氧-L-核糖,该中间体与腺嘌呤等有机碱形成的核苷衍生物在癌症、乙肝、丙肝等疾病的治疗方面也具有很大的应用前景。2
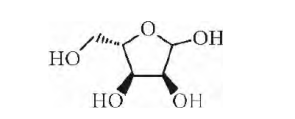
图 1
2.L-核糖的合成方法
合成L-核糖属于国际上功能糖领域的尖端技术,目前主要有化学合成法与生物合成法两种。化学合成法路线繁杂,所需试剂昂贵,副产物多,不利于L-核糖分离,最终产率不高,且存在环境污染等问题。与化学合成法相比,生物合成法以天然糖为原料,生产条件温和,副产物少,利于L-核糖的分离和回收再利用,绿色环保,更具工业化应用前景。3
3.1-氧-氟基-2,3,5-三氧苯甲酰基-L-核糖的制备
针对现有工艺中催化剂活性失效快,重复性差以及产物收率较低的问题,本文将研究探讨一种在反应过程中利用更高比表面积的催化剂,能提高产物收率的1-氧-氟基-2,3,5-三氧苯甲酰基-L-核糖的制备方法。这种方法具体包括以下步骤:S1:制备固体酸催化剂PISA/Gu-O-GN;S2:以L-核糖为原料,通过甲基化反应得到1-氧-甲基-L-呋喃核糖,之后将1-氧-甲基-L-呋喃核糖通过苯甲酰基化反应得到1-氧-甲基-2,3,5-三氧苯甲酰基-L-呋喃核糖;S3:将步骤S2所得产物,在固体酸PISA/Gu-O-GN存在下,通过乙酰化反应制得1-氧-乙酰基-2,3,5-三氧苯甲酰基-β-L-呋喃核糖。反应过程中,通过超声波间歇式震荡反应溶液,之后通过去乙酰基制备得到1-氧-2,3,5-三氧苯甲酰基-β-L-呋喃核糖;S4:由步骤S3所得产物,通过氟基化反应,制备1-氧-4-氟基-2,3,5-三氧苯甲酰基-L-呋喃核糖4。
更具体的,上述步骤中S1中固体酸PISA/Gu-O-GN的制备方法,包括以下具体步骤:S11:制备石墨烯悬浮液;氧化石墨烯与肼加入到反应釜,超声波分散,升温至反应温度进行反应,得到石墨烯沉淀物。沉淀物用洗涤,再次加入水,超声分散得到石墨烯悬浮液;S12:40℃至80℃温度下,将氢氧化铜溶液在搅拌条件下加入到石墨烯悬浮液中,氢氧化铜通过金属键嵌入石墨烯。过滤,洗涤,烘干,得到前驱体Gu-O-GN;S13:将前驱体加入到甲苯磺酸中,过滤,干燥;S14:煅烧,得到PISA/Gu-O-GN固体酸。而在步骤S2中,通过甲基化反应得到1-氧-甲基-L-呋喃核糖的具体方法为:以L-核糖为原料,将L-核糖、吡啶和甲醇混合后,再加入二氯亚砜,并在0℃水浴下保温密闭搅拌反应10h,减压蒸干得到1-氧-甲基-L-呋喃核糖;通过苯甲酰化反应制备1-氧-甲基-2,3,5-三氧苯甲酰基-L-呋喃核糖的具体方法为:将步骤S1所得产物,溶解于二氯甲烷和吡啶中,在冰水浴中冷却并搅拌下滴加苯甲酰氯,密闭搅拌反应2h—5h,反应液通过氯化钠溶液洗涤,取溶剂层,用无水硫酸镁干燥,过滤,减压蒸溶剂的糖浆。
4.1-氧-氟基-2,3,5-三氧苯甲酰基-L-核糖制备工艺的优势
本文研究探讨的这种1-氧-氟基-2,3,5-三氧苯甲酰基-L-核糖的制备方法通过在乙酰化反应制得生产中间产物1-氧-乙酰基-2,3,5-三氧苯甲酰基-β-L-呋喃核糖过程中,加入固体酸催化剂PISA/Gu-O-GN,其催化率提高至95.8%,较现有液态酸催化剂、固体酸催化剂等催化率提高了20%-50%;此外,这种制备工艺与传统固体酸相比采用石墨烯悬浮液作为载体,分散性好,所得催化剂比表面积比传统氧化硅等介孔材料得到产物大,催化性好;且产物中铜盐与石墨烯配比更灵活可控,可通过调节二者比例控制催化活性,另外,由于石墨烯所有的p轨道相互垂直,使p轨道中的电子可以在整个碳原子平面中运动,所以有金属键,故而石墨烯的金属键可以与氢氧化铜相互键合,氢氧化铜嵌入石墨烯形成前驱体,连接时,铜一边连接PISA,一边链接石墨烯,形成稳定的空间立体连接结构,具有空间立体分布结构的铜基固体酸拥有更大的比表面积,催化剂的有效酸中心数增多,活性位点增多,催化活性显著提高5。
5.1-氧-氟基-2,3,5-三氧苯甲酰基-L-核糖制备工艺的具体实例
下面将结合具体的制备实例对本文所探讨的1-氧-氟基-2,3,5-三氧苯甲酰基-L-核糖的制备工艺进行更加清晰的描述。
本文所研究的制备1-氧-氟基-2,3,5-三氧苯甲酰基-L-核糖的方法以L-核糖为原料,将L-核糖、吡啶和甲醇混合后,再加入二氯亚砜,并在0℃水浴下保温密闭搅拌反应10h,减压蒸干得到1-氧-甲基-L-呋喃核糖;将1-氧-甲基-L-呋喃核糖溶解于二氯甲烷和吡啶中,在冰水浴中冷却并搅拌下滴加苯甲酰氯,密闭搅拌反应4h,反应液通过氯化钠溶液洗涤,取溶剂层,用无水硫酸镁干燥,过滤,减压蒸溶剂的糖浆1-氧-甲基-2,3,5-三氧苯甲酰基-L-呋喃核糖;取1-氧-甲基-2,3,5-三氧苯甲酰基-L-呋喃核糖,加入固体酸PISA/Gu-O-GN、醋酸和醋酐,固体酸PISA/Gu-O-GN用量为1-氧-甲基-2,3,5-三氧苯甲酰基-L-呋喃核糖总量的10%,在0℃水浴下保温密闭搅拌反应5h;40W功率下通过超声波间歇式震荡反应溶液;浓缩,结晶,洗涤,滤干,得固体1-氧-乙酰基-2,3,5-三氧苯甲酰基-β-L-呋喃核糖;取1-氧-乙酰基-2,3,5-三氧苯甲酰基-β-L-呋喃核糖,加入二氯甲烷溶解,加醋酐,通入HCL气体,在-5℃保温密闭搅拌反应4—6h,反应结束后,加饱和碳酸氢钠溶液,搅拌,静置,取萃取层,萃取液中加咪唑、硫酰氯在25℃保温密闭搅拌反应16—24h,反应结束使用加饱和碳酸氢钠溶液,搅拌,取溶剂层;溶剂层干燥,过滤,浓缩,结晶,烘干,得固体1-氧-2,3,5-三氧苯甲酰基-β-L-呋喃核糖;将固体1-氧-2,3,5-三氧苯甲酰基-β-L-呋喃核糖,用乙酸乙酯溶解,加氢氟酸三乙胺,80℃保回流搅拌反应18h—25h,反应结束后加饱和碳酸氢钠溶液,取溶剂层;减压浓缩,结晶,过滤,烘干,得固体1-氧-4-氟基-2,3,5-三氧苯甲酰基-L-呋喃核糖。
其中,制备固体酸PISA/Gu-O-GN;具体方法为:氧化石墨烯与肼按照1:1.5的比例加入到反应釜中,超声波分散2h,然后升温至100℃,反应4h,得到石墨烯沉淀物,沉淀物用无水乙醇洗涤三次,再次加入3倍的水,超生分散得到石墨烯悬浮液;石墨烯悬浮液的浓度为0.35mg/mL,40℃温度下,将氢氧化铜溶液加入到石墨烯悬浮液中,保证石墨烯与铜元素的摩尔比为1:1.6,室温搅拌24h,沉淀过滤,无水乙醇洗涤,120℃烘干,得到前驱体Gu-O-GN;将前驱体加入到甲苯磺酸中,每克前驱体配甲苯磺酸12ml,室温下,30W功率下超声波间歇震荡24h,每次超声波震荡间隔时间为25min,150℃干燥,移到陶瓷容器中,放入马弗炉,在300℃下煅烧6h,得到PISA/Gu-O-GN固体酸。
结语
随着低毒高活性的L-核苷类药物、寡核苷酸等的生产和新药研发的需求,L-核糖的需求量将日益增多,其合成研究也将取得更大的进展6。针对生物糖技术领域这一热点发展背景,研究改进现有制备工艺,进一步推动生物糖技术领域应用是我们相关科学技术型企业必须时刻关注的问题。
参考文献
[1]张卫红,冯亚青,战佩英.L-核糖的合成研究进展[J].有机化学,2002,22(3):153-158.
[2]詹伊婧,徐铮,许露,等.L-核糖的生产研究进展[J].生物加工过程,2013,11(5):74-78
[3]王静,武首香.L-核糖的生物合成及其在药物中的应用[J].化学与生物工程.2016,33(07).
[4]祁世波,张卫红,冯亚青.L-核糖的化学合成[J].天然气化工,2007,32(1):69-78.
[5]奚强,李俊,林丫丫,等.L-核糖的合成[J].武汉工程大学学报,2009,31(5):19-20.
[6]曹玉华,王关斌,聂勇来,等.阿拉伯糖催化制取L-核糖的工艺研究[J].河南化工,2010,27(8):48