贵州省 遵义市第十八中学 563000
摘要:化学工艺流程以化学工业情景为背景,内容广泛,包括元素化合物,基本概念,基本原理,实验技能等,主要考察学生学生接受、吸收、整合化学信息的能力;分析和解决化学问题的能力;化学实验与探究能力。最终让学生发现和提出有探究价值的化学问题,能依据探究目的设计并优化实验方案,完成实验操作,能对观察记录的实验信息进行加工并获得结论;能和同学交流实验探究的成果,提出进一步探究或改进实验的设想;能尊重事实和证据,不迷信权威,具有独立思考、敢于质疑和批判的创新精神。
关键词:化学工艺流程;基本概念;基本原理;实验技能探究能力;创新精神
一、试题评析
高考理综化学试题围绕社会生活中的重大时代主题和化学前沿成果,精心选取日常生活、生产环保、学术探索、实验探究等情境素材,聚焦学科主干内容,坚持考核必备知识,突出考查关键能力,发挥学科独特的育人功能,提升考试评价的积极导向作用,发展学生的学科核心素养。
二、近三年全国卷Ⅲ工艺流程题解析与评价
试卷注重理论联系实际,呈现真实化学应用情境,注重关键能力考查。本题主要考查金属及其化合物的性质、沉淀溶解平衡常数Ksp的计算、氧化还原离子反应方程式的书写等知识点,需要学生具有很好的综合迁移能力,解答关键在于正确分析出工艺流程原理,以实际工艺流程和数据图表的形式呈现信息,考查学生信息吸收与加工、解决化工生产实际问题的能力。
(2020年全国卷Ⅲ)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
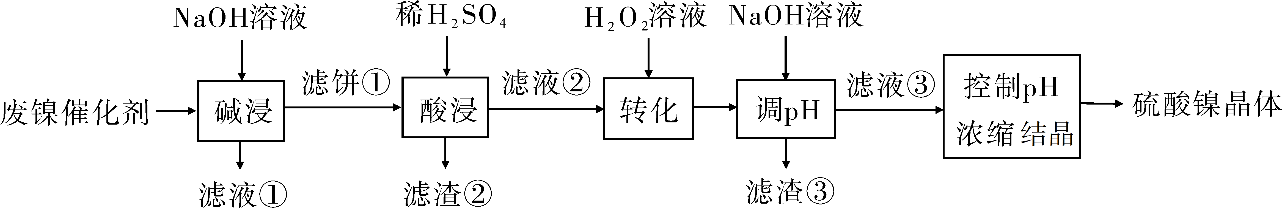
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
开始沉淀时(c=0.01 mol·L−1)的pH 沉淀完全时(c=1.0×10−5 mol·L−1)的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________。
(2)“滤液②”中含有的金属离子是______________。
(3)“转化”中可替代H2O2的物质是______________。若工艺流程改为先“调pH”后“转化”,即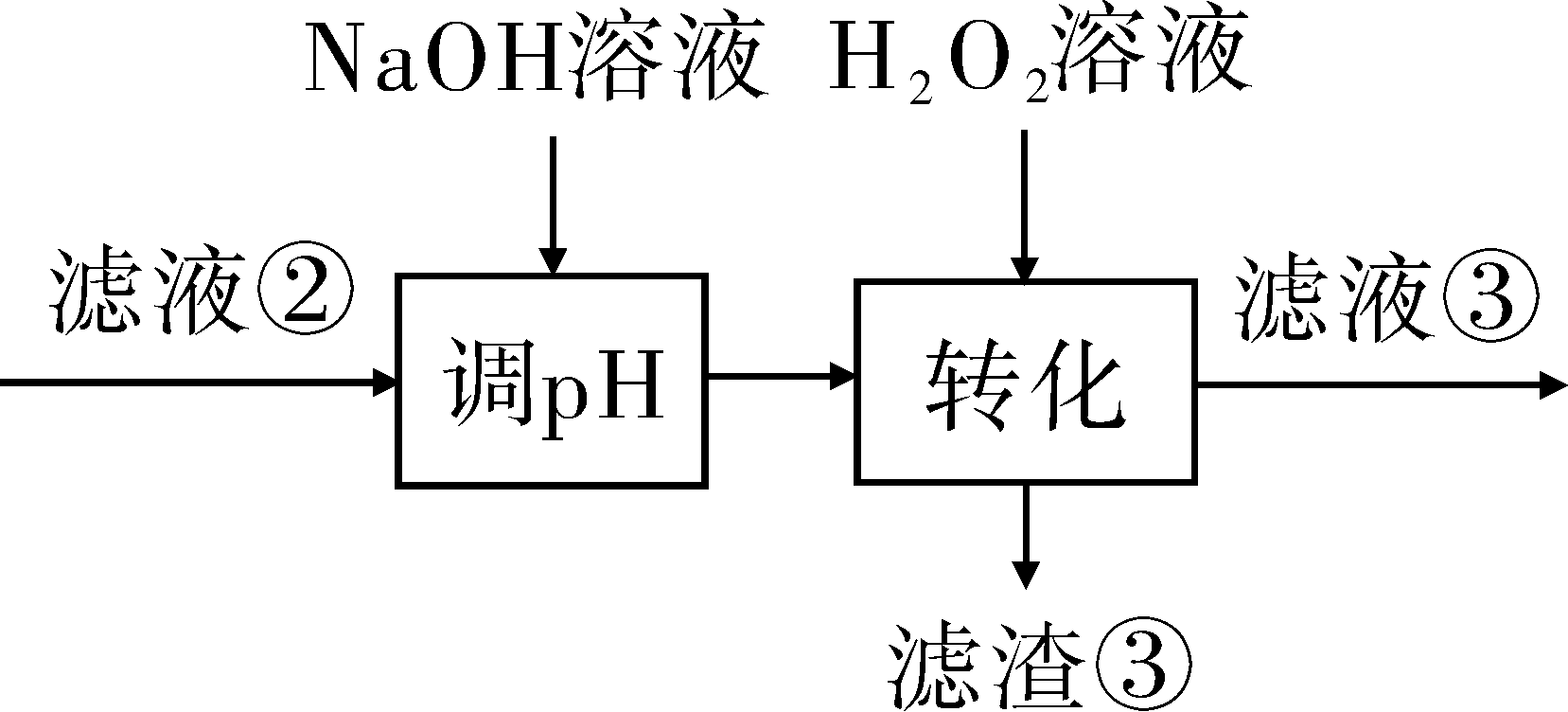 “滤液③”中可能含有的杂质离子为______________。
“滤液③”中可能含有的杂质离子为______________。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=______________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L−1,则“调pH”应控制的pH范围是______________。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________。
【解析】(1)根据分析可知,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并将Al及其氧化物溶解,滤液①中含有NaAlO2(或Na[Al(OH)4]),加入稀硫酸可发生反应![]() +H++H2O=Al(OH)3↓或
+H++H2O=Al(OH)3↓或![]() +H+=Al(OH)3↓+H2O,故答案为:除去油脂、溶解铝及其氧化物;
+H+=Al(OH)3↓+H2O,故答案为:除去油脂、溶解铝及其氧化物;![]() +H++H2O=Al(OH)3↓或
+H++H2O=Al(OH)3↓或![]() +H+=Al(OH)3↓+H2O;
+H+=Al(OH)3↓+H2O;
(2)加入稀硫酸酸浸,Ni、Fe及其氧化物溶解,所以“滤液②”中含有的金属离子是Ni2+、Fe2+、Fe3+;
(3)“转化”在H2O2的作用是将Fe2+氧化为Fe3+,可用O2或空气替代;若将工艺流程改为先“调pH”后“转化”,会使调pH过滤后的溶液中含有Fe2+,则滤液③中可能含有转化生成的Fe3+;
(4)本题根据表格,大多数学生都会填写3.2~7.2,该题针对我校学生的基础,是一个难题,考试往往会放弃此题
(5)由题干信息,硫酸镍在强碱中被NaClO氧化得到NiOOH沉淀,即反应中Ni2+被氧化为NiOOH沉淀,ClOˉ被还原为Clˉ,则根据氧化还原得失电子守恒可得离子方程式为2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O,故答案为:2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O;
(6)分离出硫酸镍晶体后的母液中还含有Ni
2+,可将其收集、循环使用,从而提高镍的回收率。
【评价】1、本题主要考查金属及其化合物的性质、沉淀溶解平衡常数Ksp的计算、氧化还原离子反应方程式的书写等知识点,需要学生具有很好的综合迁移能力,解答关键在于正确分析出工艺流程原理,难点在于Ksp的计算及“调pH”时pH的范围确定。
某油脂厂废弃的物质中回收其中的镍制备硫酸镍晶(NiSO4·7H2O),体现了资源的合理利用以及贯彻绿色化学理念。
“转化”中可替代H2O2的物质发散学生的思维,在化工生产中试剂的选择并不唯一,但要考虑生产成本,使经济效益最大化。
三、复习策略
1、本题知识:原料预处理方式、化学方程式、离子方程式的书写、条件的控制、平衡体系的移动、试剂作用、化学成分的确定、实验操作及目的分析、物质的分离和提纯、物质循环分析、简单计算等
2、策略
(1)专题复习,回归课本(整理中学阶段涉及的常见工艺流程)
1、从铝土矿中冶炼铝的工艺流程
2、海水中提取镁的工艺流程
3、废铁屑制绿矾的工艺流程 4、黄铜矿冶炼铜的工艺流程
5、卤块制备轻质氧化镁 6、硫酸、硝酸工业制备
7、合成氨工业 8、侯氏制碱的原理 9、氯碱工业
(2)做题时先看目的,拿到题不要着急把整个工艺流程过程看懂,先做题,体现流程图的再返回观察,工艺流程题中并不是每道题都需要流程图,只有几问需要
(3)懂得取舍,理综时间毕竟紧凑,高考是有区分度的,遇到实在不会的,不要停留,要做到快、狠、准,不要患得患失
四、总结
今年有幸参与高考阅卷,恰好是工艺流程题,感触颇深:对于工艺流程题,本身情景来源于化学工业生产,在化学工业生产中,不仅要严谨、还要考虑利益的最大化和对环境的友好型。在接下来的教学中,一定要关注学生答题的科学性,严谨性、合理性,不要凭空写答案,一定是有据可依的,在答题时,一定要注意化学用语的书写,不要烦琐,抓住题意,让自己的答案简单整洁,条理清晰,对于高考,它本身是有区分度的,对于我校基础较为薄弱,要教会学生如何取舍,不要做无谓的挣扎。
参考文献
[1]、教育部考试中心,2019年普通高等学校招生统一考试大纲[M],高等教育出版社,2019
[2]、侯承舜,五年高考三年模拟(化学),首都师范大学出版社,2019