摘要:以“新型净水剂高铁酸钾的制备”为项目主题内容,面向已经进入高考一轮复习的高三年级学生开展项目教学活动,学生通过完成“收集展示K2FeO4的制备方案及评价”、“K2FeO4制备的主体流程设计”等项目任务,提高学生获取及处理信息的能力,强化学生应用所学知识解决实际生活生产问题的素养,同时借助子任务“自主命题”,掌握处理同类问题的一般方法,提高学生的思维品质,完成知识的深度学习,实现知识的横向与纵向延伸,从而高效完成“高三一轮复习中元素及其化合物——铁及其重要化合物复习专题”的教学,提升复习的实效性。
关键词:元素化合物;高铁酸钾;制备方案;自主命题;学科素养
高考试题承载着社会发展热点,引导我们当下教学环节的设计与开展,在化学学科素养的指导下,高考命题常以真实情境为载体,以解决实际问题为测试任务。因此,高三一轮复习应紧扣教材,掌握基础知识,同时更应注重理论联系实际。水体的净化问题已成为当今社会尤为关注的问题,高铁酸钾作为绿色高效水处理剂,近年来俨然成为试题考查中的热门考点,其中的关键因素——铁元素,为课标[1]元素化合物部分中要求掌握的重点内容,围绕K2FeO4的制备开展的学习能帮助学生高效整合包含“氧化还原反应”、“电化学”、“盐类水解”、“滴定分析”等多方面的基础知识,同时通过有效项目——“自主命题”的创设,使学生站在“命题人”的高度,真正意义上感受“揣摩出题人意图”的真谛,帮助学生全方位提高工艺流程题的解题能力,培养学生良好的解题和答题习惯。
笔者在进行教学实践中,考虑到高三课下仍时间紧任务重的现实,在开展项目式教学活动时,以两节课为一个教学单元开展复习,避免了创设的项目活动流于形式,真正促使学生展开自主学习,合作探究,深入地去思考研究课堂内容,培养良好的学习思维,形成良好的学习氛围。
1教学目标[2]和项目流程
通过创设真实的问题情境,通过氧化还原反应原理、电解原理等知识分析K2FeO4的制备方法,借助网络资源及文献查找完善K2FeO4的制备方案,同时运用所掌握的“化学实验基本操作”,整合信息及知识合作完成“K2FeO4制备的主体流程设计”;
(2)在完善“K2FeO4制备的主体流程设计”的基础上,引导学生自主展开相关命题,打破学生对于高考化学工艺流程题的恐惧感,建立解答制备类工业流程题的思维模型,提升解题能力的同时实现相关知识的全面巩固;
(3)通过真实问题的解决,体会化学学科价值,提升学生对于化学制备的认识。项目具体的学习流程如图1所示[3]。
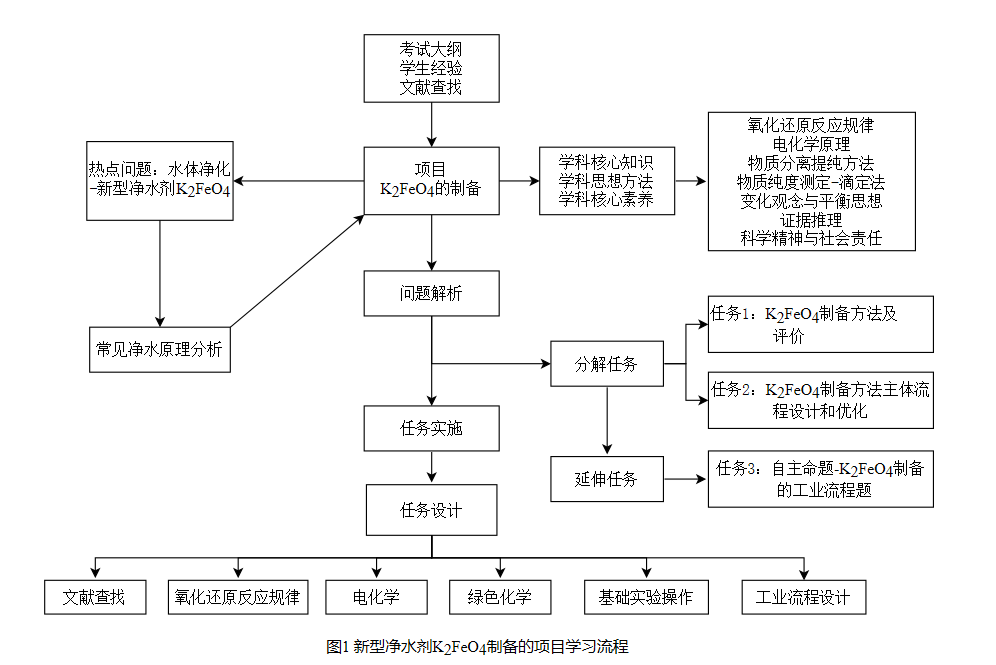
2教学过程
2.1任务1:K2FeO4的制备方案及评价
[情境]:视频展示——水污染现状及常用治理方法
[教师]:水作为生命之源,它的净化问题关系人民福祉,明矾净水,活性炭吸附,臭氧杀菌消毒,这些都是我们所熟悉的净水原理。那么今天老师给大家带来了一种集絮凝,吸附,氧化和杀菌消毒等多功能为一体的新型绿色净水剂——高铁酸钾,同步展示实验室制备的高铁酸钾。
[追问]:从铁及其化合物中能否找寻出合适的原料来制备高铁酸钾?
[学生活动1]:分析猜想:高铁酸钾中的铁为+6的铁,而我们所熟悉的铁盐为+2,+3价,所以需找到合适的氧化剂,将低价态的铁氧化为高价态的铁。
[教师补充]:根据表1常见氧化剂的电极电位[7],在PH<2的条件下,高铁酸钾具有比臭氧,双氧水和高锰酸钾等常见氧化剂更强的氧化性,碱性下,高铁酸钾氧化还原的电极电位会有所下降,低价态铁盐容易被氧化为高铁酸盐易于制备产生[5]。
氧化剂 | 氧化电位(V) | 氧化剂 | 氧化电位(V) |
F2 | 3.06 | ClO2 | 1.50 |
O3 | 2.07 | Cl2 | 1.36 |
H2O2 | 1.77 | ClO- | 1.49 |
MnO4- | 1.66 | Cr2O72- | 1.33 |
O2 | 1.23 | MnO2 | 1.68 |
K2FeO4(酸性) | 2.20 | K2FeO4(碱性) | 0.72 |
表1 常见氧化剂电极电位表
[教师]:高铁酸钾制备原理的关键在于氧化剂的选择,而在实际工业生产中则需考虑更多因素,为了方便同学们更好更快地去了解高铁酸钾制备的国内外研究现状,依据文献检索的一般步骤,课前老师和各组组长通过知网及网络检索“高铁酸钾”关键词,分析整合,整理出了相关文献。
[学生活动2]:小组分工合作归纳整体出高铁酸钾的制备方法。
[教师]:组织学生交流,互评,总结,评价方案优劣。
[学生成果展示1]:过氧化物法制备K2FeO4[4]
原理:2Fe2O3 + 6K2O2 = 2K2FeO4 + 5H2O
在文献检索的过程中,我们组发现更多的是先制备Na2FeO4 , 然后利用溶解度的差异获得K2FeO4 。
原理:2FeSO4 + 6Na2O2 = 2Na2FeO4 + 2Na2O +2Na2SO4 +O2或 Fe + 3Na2O2 = Na2FeO4 + 2Na2O
Na2FeO4 +2KOH = K2FeO4 + 2NaOH
在这些反应中,低价态的Fe作为还原剂,碱金属的过氧化物作为氧化剂,发生氧化还原反应;
这种方法,虽然操作步骤简单,反应物少,但由于反应放热在升温过程中能够引起爆炸,危险性很高,因而难以实现工业化生产,并且在制备过程中常因混有多种价态的铁酸盐而使纯度降低。
[学生成果展示2]:次氯酸盐氧化法制备K2FeO4 [5]
原理:3ClO - + 2Fe3+ + 10OH - = 2FeO42 - + 3Cl - + 5H2O
查阅资料我们发现在实际工业生产中,因需要氯气,对设备的气密性及耐腐蚀性均有较高的要求,实际操作困难,综合成本较高。后期的制备研究多以次氯酸盐为氧化剂在碱金属氢氧化物存在环境下直接与三价铁反应,沉淀出高铁酸钾晶体[5]。
[学生成果展示3]:电解法制备K2FeO4



图2电解法制备K2FeO4
图3电解法制备K2FeO4原理
阳极:Fe-6e-+8OH- = FeO42-+4H2O
阴极:2H2O+2e- = H2↑+2OH-
总式:Fe+2OH-+4H2O= FeO42-+3H2↑
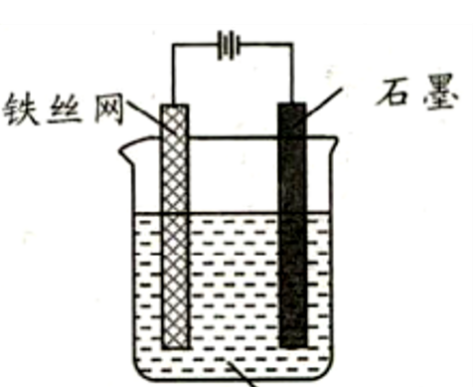
通过资料[4]查找,我们发现在实际操作中需综合考虑的因素很多:电极材料的活性、电解液的组成、电解槽的结构、隔膜材料等等,这些因素都会对制备效率产生影响,但毋庸置疑,电解法操作简单、工艺环保、产品纯度高、综合成本低等优势,必将成为工业化生产的最佳选择。
[教师概括总结,引导学生归纳整理]
[学生成果展示4]:K2FeO4 制备方法及优缺点
制备方法 | 优点 | 缺点 |
干法 2Fe2O3 + 6K2O2 = 2K2FeO4 + 5H2O | 产品批量大 步骤简单 | 操作危险性高,产品纯度较低,杂质含量较高。 |
湿法 3ClO - + 2Fe3+ + 10OH - = 2FeO42 - + 3Cl - + 5H2O | 工艺纯熟 纯度高 | 工艺繁杂,操作困难,产率较低,综合成本高 |
电解法 Fe-6e-+8OH- = FeO42-+4H2O | 工艺环保 操作简便 | 能耗高,操作稳定性差,电流效率制约因素多 |
表2:K2FeO4制备方法及优缺点
2.2任务2:K2FeO4主体工业流程设计
[教师]:经过同学们的分析和总结,我们能够看出利用次氯酸盐氧化法制备高铁酸钾显然是比较适合当今工业生产水平的,那么原料的选取上大家能否从我们所熟悉的工业制备上找寻呢?
[学生活动3]:学生小组讨论分析。
[教师]引导学生思考方向,组织学生交流、总结。
[学生]:次氯酸盐氧化法的反应物为三价铁和次氯酸盐,次氯酸盐我们可以利用氯碱工业直接获取,而三价铁的来源我们想到利用铁矿,课本硫一节我们知道硫铁矿是硫酸工业的原料,硫铁矿燃烧产生SO2和Fe2O3,可以利用硫酸工业的燃渣作为铁的来源。
[教师补充]:硫酸烧渣主要成分Fe2O3,此外烧渣中还有Al2O3、SiO2以及不溶于酸等杂质[7]。
[学生活动4]:根据工业流程设计的一般方法[3]设计从硫酸烧渣制备高铁酸钾的工艺流程图,小组讨论交流,各组间交流本组设计,交流思路,设计如图4相对完善的主体流程。

图4 K2FeO4制备的主体工业流程
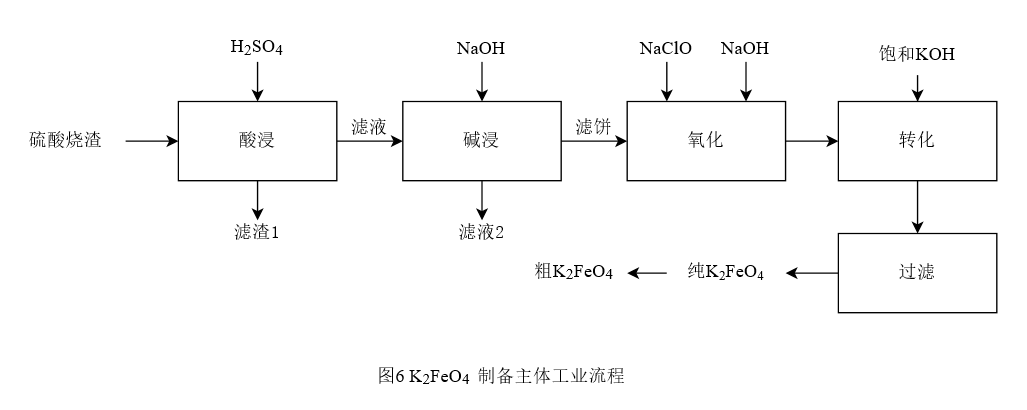
[教师]:组织学生交流、互评、总结评价。
[教师补充]:在实际的生产过程中,我们需要综合考虑的因素很多,铁盐的种类,氧化剂浓度,反应温度,提纯过程(结晶,过滤,脱水,冲洗)都会对高铁酸钾的产率和纯度造成影响,但只有通过我们的知识作为依托,通过不断的实验改进,最后才能付诸实践,进入工业生产阶段。
2.3任务3:自主命题——K2FeO4制备的工业流程题
[学生活动5]:小组合作分工,整合资料,依据图5指示的工业流程题常见命题点[10],参考高考命题形式,设计题目,分析过程,整理答案,进行成果展示。

图5 化学工业流程题一般命题方向
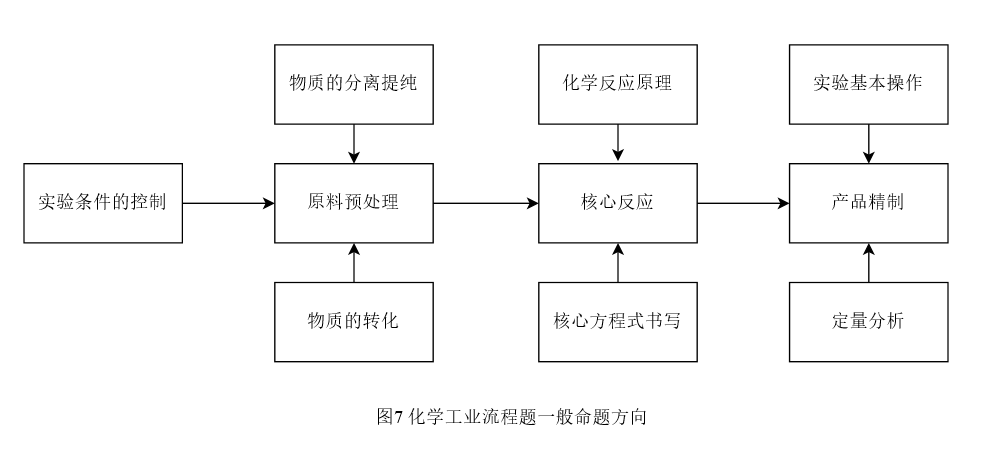
[教师]:引发学生的研讨和质疑,做好试题的拓展及补充,及时的点拨,引导学生对试题解决进行梳理归纳,总结反思。
[学生成果展示4]:
(14分)某硫酸厂生产过程中产生的废渣,主要成分为Fe2O3,还有少量的Al2O3、SiO2以及不溶于酸等杂质,采用如图4工业流程以硫酸烧渣为原料制备新型净水剂K2FeO4:
已知:K2FeO4易溶于水,在强碱性环境中溶解度小,难溶于无水乙醇等有机溶剂。
滤渣1的主要成分________(填化学式),为提高酸浸时的反应速率,通常可采用的措施是_________________________________(答一点);
滤液2中含有的阴离子有___________________;
氧化阶段发生的化学方程式为______________________________________;
由粗K2FeO4 提纯K2FeO4的过程中涉及的操作名称__________,后经过滤,洗涤,干燥实现脱碱脱水,洗涤可以用__________洗涤;
测定所制备的K2FeO4的纯度(杂质不与KI反应):取0.210g高铁酸钾样品,加入足量H2SO4酸化的KI溶液,充分反应后,用0.200mol/LNa2S2O3标准溶液滴定[8],重复三次操作,所用Na2S2O3标准溶液的体积为19.80ml,已知:FeO42-被I-还原为Fe2+,2S2O32-+I2=S4O62-+2I-
①滴定时所选用的指示剂为____________,滴定终点的现象_______________________________;
②所测K2FeO4的纯度_______________。(保留三位有效数字)
3项目教学反思
以“社会热点”——新型净水剂高铁酸钾的制备为项目,通过学生自主分析,小组合作查阅学习资料,学生互学互评,教师引导补充的学习方式,使学生感悟并深化元素化合物,氧化还原及工艺流程的相关知识,使学生能够将所学知识结构化并能把解决问题思路化,借助自主命题环节,引发学生对问题的深度思考,实现知识的深度学习,能够使所学内化为学生的认知和能力,形成稳定的学科素养;
但在项目的实施过程中,局限于高三时间的紧迫及现有实验条件,无法开展课堂实验,不能使学生获得更深层次的知识体验,但通过真实的项目创设,自主命题的环节设置,使高三学生获得及应用知识的能力大幅度提高,充分调动起学生自主学习的热情,课堂结构得以优化,效率得以提高,学生综合学科素养得以提升。
参 考 文 献
中华人民共和国教育部制定. 普通高中化学课程标准( 2017 版) [S]. 北京: 人民教育出版社,2018.
杨玉琴,倪娟. 学科核心素养视域下的教学目标: 科学研制与准确表达[J].化学教学,2019,( 3) : 3~7
韩 晓,江合佩,王朝晖.基于真实情境的项目式教学——以“粗硅的提纯及其原理”为例[J].化学教学,2020,( 4) : 46~50
张运波,王一凡,王洪波.绿色水处理剂高铁酸钾制备研究进展[J].工业水处理,2020,( 40) : 10~14
刘玉蕾.高铁酸钾的制备及去除水中铊、吲哚 和处理污水厂污泥的效果与机理[D].黑龙江:哈尔滨工业大学,2018
朱良.基于高铁酸钾(K2FeO4)的氧化性研究[J].当代化工研究,2020,( 16) :21~22
李德明.硫酸烧渣制备絮凝剂PPFS及在废水处理上的应用[D].安徽:合肥工业大学,2010
但晓武,罗志勇,张梦,代梅.硫代硫酸钠置换滴定法测定高铁酸盐的纯度.[J].理化检验(化学分册),2020,( 56) :528~531
胡先锦.学生自主命题教学模式在工艺流程题复习中的应用.化学教学,2013,( 9) : 55~57
赵铭.化学工业流程题溯源、特点及价值思考[J].化学教学,2017,( 2) :82~85

5